Διαφορά μεταξύ αλειφατικών και αρωματικών υδρογονανθράκων | Αλειφατική εναντίον αρωματικών υδρογονανθράκων
Βασικά διαφορά - αλειφατικές vs αρωματικοί υδρογονάνθρακες
Ας πρώτα εν συντομία δούμε τι υδρογονάνθρακες συζητούν τη διαφορά μεταξύ αλειφατικούς και αρωματικούς υδρογονάνθρακες. Οι υδρογονάνθρακες είναι οι οργανικές ενώσεις που περιέχουν άτομα άνθρακα και υδρογόνου στη δομή τους. Η βασική διαφορά μεταξύ αλειφατικοί και αρωματικοί υδρογονάνθρακες είναι, αλειφατικούς υδρογονάνθρακες δεν περιέχουν ένα συζευγμένο σύστημα του δεσμού λαμβάνοντας υπόψη ότι αρωματικούς υδρογονάνθρακες περιέχουν ένα συζευγμένο σύστημα δεσμό. Ωστόσο, και τα δύο αυτά μόρια θεωρούνται ως οργανικές ενώσεις.
Τι είναι αλειφατικοί υδρογονάνθρακες ;
Οι αλειφατικοί υδρογονάνθρακες είναι τα οργανικά μόρια που περιέχουν άτομα άνθρακα (C) και υδρογόνου (H) στη δομή τους. σε ευθείες αλυσίδες, διακλαδισμένες αλυσίδες ή μη αρωματικούς δακτυλίους. Οι αλειφατικοί υδρογονάνθρακες μπορούν να κατηγοριοποιηθούν σε τρεις κύριες ομάδες. αλκάνια, αλκένια και αλκύνια.
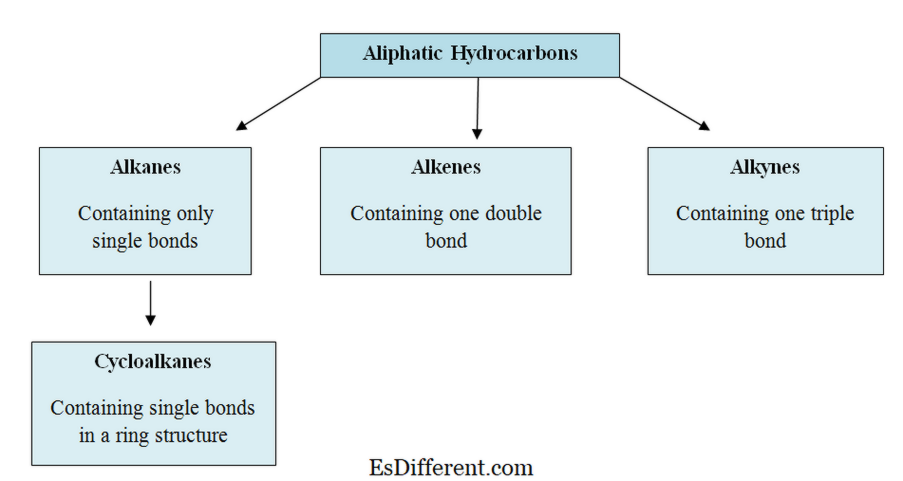
Τι είναι Αρωματικοί Υδρογονάνθρακες ;
Οι αρωματικοί υδρογονάνθρακες είναι μερικές φορές γνωστοί ως " αρένες " ή " αρυλ υδρογονάνθρακες ". Οι περισσότεροι αρωματικοί υδρογονάνθρακες περιέχουν έναν δακτύλιο βενζολίου στη δομή τους. αλλά υπάρχουν μη-βενζόλιο αρωματικούς υδρογονάνθρακες που ονομάζεται heteroarenes , τα οποία ακολουθούν το « κανόνα Huckle του » (κυκλικούς δακτυλίους που ακολουθούν κανόνα του Huckle έχουν 4n αριθμό + 2 του π-ηλεκτρόνια, όπου η = 0, 1, 2, 3, 4, 5, 6). Ορισμένοι αρωματικοί υδρογονάνθρακες έχουν περισσότερους από έναν δακτυλίους. ονομάζονται πολυκυκλικοί αρωματικοί υδρογονάνθρακες .

Μια απεικόνιση χαρακτηριστικών πολυκυκλικών αρωματικών υδρογονανθράκων.
Ποια είναι η διαφορά μεταξύ αλειφατικών και αρωματικών υδρογονανθράκων;
Δομή αλειφατικών και αρωματικών υδρογονανθράκων
Αλειφατικοί υδρογονάνθρακες: Έχουν στη δομή τους ευθείες αλυσίδες, διακλαδισμένες αλυσίδες ή μη αρωματικούς δακτυλίους. Αυτή η ομάδα έχει κορεσμένους και ακόρεστους υδρογονάνθρακες. Τα αλκάνια είναι κορεσμένοι υδρογονάνθρακες, τα αλκένια και τα αλκύνια είναι ακόρεστοι υδρογονάνθρακες.
ευθείες αλυσίδες:

Octane
Τα επώνυμα Αλυσίδες:

5-αιθυλο-3-methyloctane

2-μεθυλ-3-pentence
για μη αρωματικούς δακτυλίους:

Αρωματικοί Υδρογονάνθρακες: Οι αρωματικοί υδρογονάνθρακες έχουν σύστημα αρωματικού δακτυλίου στη δομή τους. Είναι όλοι οι ακόρεστοι υδρογονάνθρακες, αλλά σχετικά σταθεροί λόγω του συζευγμένου συστήματος δεσμών.
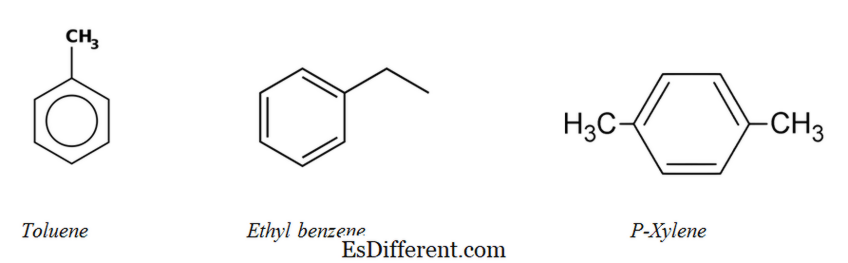
Αλειφατικοί υδρογονάνθρακες:
Υπάρχουν τρεις κύριες ομάδες αλειφατικών υδρογονανθράκων. αλκάνια, αλκένια και αλκύνια. Είναι επίσης γνωστοί ως αλλυλοϋδρογονάνθρακες .
Αλκάνες: Στα αλκάνια, τα άτομα άνθρακα και υδρογόνου συνδέονται μαζί με απλούς δεσμούς. Δεν έχουν πολλαπλούς δεσμούς. Τα αλκάνια σχηματίζουν δομές δακτυλίου, ονομάζονται κυκλοαλκάνια.

Αlkenes : Αυτή η ομάδα περιέχει τόσο μονή όσο και διπλούς δεσμούς μεταξύ ατόμων άνθρακα. Τα άτομα υδρογόνου και άνθρακα σχηματίζουν πάντα απλούς δεσμούς.
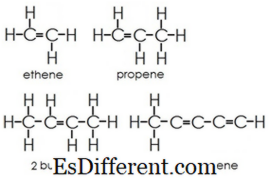
Αλκυλοί: Οι αλκύνιοι έχουν τριπλούς δεσμούς μεταξύ των ατόμων άνθρακα εκτός από τους απλούς δεσμούς.

Αρωματικοί Υδρογονάνθρακες:
Οι περισσότεροι από τους αρωματικούς υδρογονάνθρακες περιέχουν τουλάχιστον ένα βενζολικό δακτύλιο στη δομή τους. Αλλά υπάρχουν λίγοι μη βενζολικοί αρωματικοί υδρογονάνθρακες, οι οποίοι ονομάζονται "ετεροάρες". Οι αρωματικοί υδρογονάνθρακες ονομάζονται "αρυλ" υδρογονάνθρακες.

Διφαινύλιο (Αρωματικός υδρογονάνθρακας με δύο βενζολικούς δακτυλίους)
Μοτίβο δεσμεύσεως αλειφατικών και αρωματικών υδρογονανθράκων
Αλειφατικοί υδρογονάνθρακες:
Σε αλειφατικούς υδρογονάνθρακες. μονοί, διπλοί ή τριπλοί δεσμοί μπορούν να υπάρχουν οπουδήποτε στο μόριο. Μερικές φορές, μπορεί να υπάρχουν διάφορες δομές για έναν μοριακό τύπο μεταβάλλοντας τη θέση των πολλαπλών δεσμών. Αυτά τα μόρια έχουν ένα εντοπισμένο σύστημα ηλεκτρονίων.
Αρωματικοί υδρογονάνθρακες:
Σε αρωματικούς υδρογονάνθρακες, έχουν ένα εναλλακτικό σύστημα μονής και διπλής σύνδεσης για να σχηματίσουν ένα συζευγμένο σύστημα δεσμών για να απομακρύνουν τα ηλεκτρόνια. (Τα αποεπικαλυπτόμενα ηλεκτρόνια μπορούν να μετακινηθούν από έναν δεσμό στον άλλο).
Αντιδράσεις αλειφατικών και αρωματικών υδρογονανθράκων
Αλειφατικοί υδρογονάνθρακες:
Οι κορεσμένοι υδρογονάνθρακες υφίστανται αντιδράσεις υποκατάστασης. ακόρεστοι υδρογονάνθρακες επιτυγχάνουν τη σταθερότητα με αντίδραση προσθήκης. Ωστόσο, ορισμένες αντιδράσεις συμβαίνουν υπό ελεγχόμενες συνθήκες χωρίς να σπάσουν πολλαπλούς δεσμούς.
Αρωματικοί Υδρογονάνθρακες:
Οι αρωματικοί υδρογονάνθρακες είναι ακόρεστοι, αλλά έχουν σταθερό συζευγμένο σύστημα ηλεκτρονίων, έτσι ώστε να είναι πιο ευαίσθητοι σε αντιδράσεις υποκατάστασης παρά αντιδράσεις προσθήκης.
Ευγενική προσφορά εικόνας: "Πολυκυκλικοί αρωματικοί υδρογονάνθρακες" από Inductiveload - Το δικό του έργο από τον μεταφορτωτή, Accelrys DS Visualizer. (Δημόσιος τομέας) μέσω Commons