Διαφορά μεταξύ μονοτονικών και διατομικών | Μονατονική και Διατομική
Η διαφορά μεταξύ μονοτονικών και διατομικών είναι κυρίως σε σχέση με τα άτομα που υπάρχουν στο είδος. Όπως υποδηλώνουν τα ονόματα, και οι δύο αυτοί όροι αντιπροσωπεύουν διαφορετικές καταστάσεις ατομικών ενώσεων όπου «μονο» σημαίνει «ένα» και «di» σημαίνει «δύο». «Επομένως, απλά, μονοτονικό σημαίνει ένα
ένα άτομο » και το διατομικό σημαίνει « δύο άτομα. ' Ωστόσο, μπορεί να υπάρξουν τόσες πολλές διαφορετικές παραλλαγές σε αυτόν τον βασικό ορισμό.
Τι είναι το μονοατομικό;Όταν
υπάρχει ένα μόνο άτομο (το οποίο σπάνια συμβαίνει), το ονομάζουμε μονοτονικό. Αυτό σημαίνει ότι τα στοιχεία είναι στην καθαρά μοναδική μορφή τους. Το μόνο πρακτικό παράδειγμα που μπορεί να εμπίπτει σε αυτή την κατηγορία θα είναι τα ευγενή αέρια που υπάρχουν ως άτομα από μόνα τους καθώς έχουν το εξωτερικό κέλυφος τους συμπληρωμένο με ένα οκτάδιο ηλεκτρονίων. Ως εκ τούτου, δεν θέλουν να δεχτούν ή να δώσουν περισσότερα ηλεκτρόνια για να είναι πιο σταθερά. Ως εκ τούτου, τα ευγενή αέρια είναι σταθερά σε μονοτονική μορφή. Μερικά παραδείγματα είναι: Αυτός - Χελίον, Νε - Νέον, Άρ - Αργόν, Ξε - Ξένον, Κρ - Κρύπτον, Ρη - Ραδόν. Υπάρχουν επίσης και μεμονωμένα άτομα σε ιονικές μορφές, ειδικά σε λύσεις, και μερικά παραδείγματα είναι. Na +, Ca2 +, K + κλπ. Αυτά τα ιόντα έχουν μια σταθερή φόρτιση σε αυτά που σημαίνει ότι έχουν ένα σταθερό σθένος. Υπάρχουν, όμως, και άλλοι τύποι ιόντων που έχουν πολλά σθένη και μπορούν να υπάρχουν σε πολλές ιονικές μορφές, που εξακολουθούν να είναι μονοτονικές. Ένα καλό παράδειγμα είναι ο Σίδηρος. Fe2 + και Fe3 +. Δεν υπάρχουν μόνο κατιόντα (θετικά φορτισμένα) αλλά ανιόντα (αρνητικά φορτισμένα) υπάρχουν και σε μονοτονική μορφή. Τα Cl-, F-, I- είναι μερικά παραδείγματα. Αυτά τα ιοντικά είδη δεν είναι σταθερά από μόνα τους και θα αναζητούσαν φυσικά ομολόγους για να σχηματίσουν ενώσεις. Όμως, όπως αναφέρθηκε παραπάνω, μπορούν να βρεθούν σε διαλύματα κατά την υδρόλυση των ενώσεών τους. Ιονική μορφή ειδών λόγω έλλειψης σταθερότητας του μοναδικού ατόμου σε καθαρή μορφή που δεν είναι σε θέση να επιτύχει την ηλεκτρονική διαμόρφωση του ευγενούς αερίου. Επομένως, αυτά τα άτομα είτε δέχονται είτε δίνουν ηλεκτρόνια για να κερδίσουν σταθερότητα.
Helium
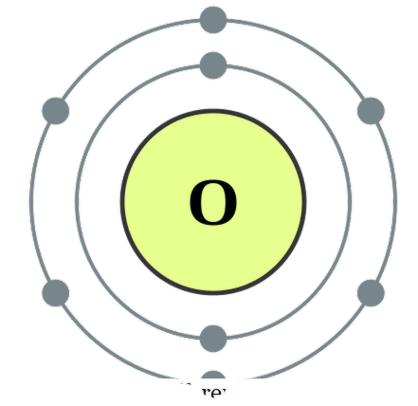
Τι είναι το Diatomic;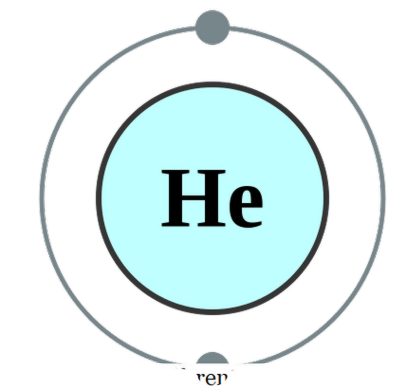
Όταν
δύο άτομα συνδέονται μεταξύ τους
, το ονομάζουμε διάτομο. Αυτά τα άτομα μπορούν να είναι από τον ίδιο τύπο ή διαφορετικά. Όταν είναι δύο παρόμοια άτομα σε συνδυασμό, το ονομάζουμε ' ομοιοπυρηνικά διατόμια ' και αν είναι κατασκευασμένα από διαφορετικούς τύπους το ονομάζουμε ' ετεροπορραυλικά διάτομα '. Παραδείγματα ορισμένων ομοπυρηνικών διατομών θα είναι 02, Ν2, Η2, κλπ. Ενώ τα CO, ΝΟ, HCl, κλπ. Μπορούν να δοθούν ως παραδείγματα για ετεροπυρηνικά διατόμια. Το οξυγόνο Τα διώματα μπορούν να θεωρηθούν ως ενώσεις καθώς σχηματίζουν αυτές τις ενώσεις για να επιτύχουν περισσότερη σταθερότητα, μοιράζοντας ηλεκτρόνια μεταξύ τους έτσι ώστε και τα δύο άτομα να επιτύχουν ηλεκτρονική διαμόρφωση ευγενών αερίων. Μπορούν να συνδεθούν μέσω ομοιοπολικών δεσμών με την επικάλυψη ατομικών τροχιακών ή αλλιώς μπορούν να σχηματίσουν μεταξύ τους ιοντικούς δεσμούς που είναι μια δύναμη έλξης μεταξύ ενός θετικά φορτισμένου είδους και ενός αρνητικά φορτισμένου είδους. Παραδείγματα ομοιοπολικών δεσμών μεταξύ των διατομών περιλαμβάνουν CO, ΝΟ, κλπ. Και το ΗΟΙ μπορεί να θεωρηθεί ως ένα είδος με χαρακτήρα ιοντικής έλξης. Ωστόσο, καθώς η δύναμη έλξης μεταξύ H + και Cl- δεν είναι πολύ ισχυρή, δεν είναι ένα πολύ καλό παράδειγμα για ιοντικούς δεσμούς που είναι ένα άλλο καθορισμένο θέμα. Ποια είναι η διαφορά μεταξύ του μονοτονικού και του διατομικού;
• Μονατομικά είδη έχουν ένα άτομο, ενώ τα διατομικά είδη έχουν δύο άτομα.
• Μονατομικά είδη γενικά δεν είναι σταθερά, αλλά τα διατομικά είδη είναι γενικά σταθερά.
• Τα ευγενή αέρια είναι μόνο μονοτονικά και δεν βρίσκονται σε διατομική μορφή.
• Υπάρχουν χημικοί δεσμοί μεταξύ διατομικών ειδών, ενώ δεν υπάρχουν δεσμοί στα μονοτονικά είδη.
Εικόνες Ευγένεια:
Διαμόρφωση ηλεκτρονίου του ηλίου από την Pumbaa (CC BY-SA 2. 0 uk)
Διαμόρφωση ηλεκτρονίων οξυγόνου από την DePiep (CC BY-SA 3. 0)



