Διαφορά μεταξύ ακεταλδεΰδης και ακετόνης | Ακεταλδεΰδη Vs Ακετόνη
Διαφορά κλειδιού - Ακεταλδεΰδη vs Ακετόνη
Και η Ακεταλδεΰδη και η Ακετόνη είναι μικρά οργανικά μόρια, αλλά υπάρχει διαφορά μεταξύ τους με βάση τις λειτουργικές τους ομάδες. Με άλλα λόγια, είναι δύο διαφορετικές ενώσεις καρβονυλίου με διαφορετικές χημικές και φυσικές ιδιότητες. Η ακετόνη είναι το μικρότερο μέλος της ομάδας κετόνης, ενώ η ακεταλδεΰδη είναι το μικρότερο μέλος της ομάδας αλδεϋδών. Η διαφορά κλειδιού μεταξύ της ακεταλδεΰδης και της ακετόνης είναι ο αριθμός των ατόμων άνθρακα της δομής η ακετόνη έχει τρία άτομα άνθρακα , αλλά ακεταλδεΰδη έχει μόνο δύο άτομα άνθρακα. Η διαφορά στον αριθμό ατόμων άνθρακα και που έχει δύο διαφορετικές λειτουργικές ομάδες οδηγεί σε πολλές άλλες διαφορές στις ιδιότητές τους.
Τι είναι η Ακετόνη;
Η ακετόνη είναι το μικρότερο μέλος της κετονικής ομάδας, επίσης γνωστή ως προπανόνη . Είναι ένα άχρωμο, πτητικό, εύφλεκτο υγρό που χρησιμοποιείται ως διαλύτης. Οι περισσότεροι από τους οργανικούς διαλύτες δεν διαλύονται σε νερό, αλλά η ακετόνη αναμειγνύεται με νερό. Χρησιμοποιείται πολύ συχνά για καθαρισμό στο εργαστήριο και ως το κύριο δραστικό συστατικό σε υγρά αφαίρεσης βερνικιών και σε αραιωτικό χρωμάτων.

Τι είναι η Ακεταλδεΰδη;
Η ακεταλδεΰδη, επίσης γνωστή ως αιθανάλη είναι το μικρότερο μέλος της ομάδας αλδεϋδών. Είναι ένα άχρωμο, εύφλεκτο υγρό με ισχυρή, ασφυκτική οσμή. Υπάρχουν πολλές βιομηχανικές χρήσεις όπως η παραγωγή οξικού οξέος, αρώματα, φάρμακα και μερικές γεύσεις.
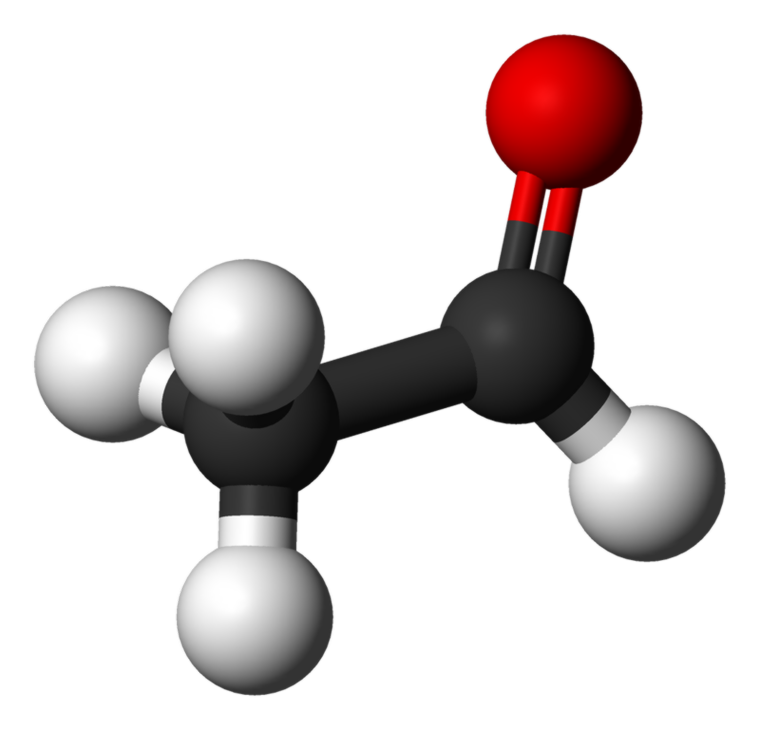
Ποια είναι η διαφορά μεταξύ της Ακεταλδεΰδης και της Ακετόνης;
Δομή και γενικές ιδιότητες ακεταλδεΰδης και ακετόνης
Ακετόνη: Ο μοριακός τύπος ακετόνης C 3 H 6 O. Είναι το απλούστερο μέλος της οικογένειας κετόνης. Είναι ένα πτητικό, εύφλεκτο υγρό με έντονη οσμή.

Ακεταλδεϋδη: Ο μοριακός τύπος της ακεταλδεΰδης C 2 Η 4 O. Είναι το απλούστερο και ένα από τα πιο σημαντικά μέλη της οικογένειας των αλδεϋδών. Είναι άχρωμο, πτητικό, εύφλεκτο υγρό στη θερμοκρασία δωματίου.

Παρουσία Ακεταλδεΰδης και Ακετόνης
Ακετόνη: Γενικά, η ακετόνη υπάρχει στο ανθρώπινο αίμα και στα ούρα. Επίσης παράγεται και διατίθεται στο ανθρώπινο σώμα κατά τη διάρκεια του φυσιολογικού μεταβολισμού. Όταν οι άνθρωποι έχουν διαβητικούς, παράγονται σε μεγαλύτερες ποσότητες στο ανθρώπινο σώμα.
Ακεταλδεΰδη: Η ακεταλδεΰδη απαντάται φυσικά σε διάφορα φυτά (καφέ), ψωμί, λαχανικά και ώριμα φρούτα.Επιπλέον, βρίσκεται στον καπνό τσιγάρων, βενζίνης και ντίζελ. Επίσης, είναι ένα ενδιάμεσο στο μεταβολισμό του αλκοόλ.
Χρήσεις ακεταλδεΰδης και ακετόνης
Ακετόνη: Η ακετόνη χρησιμοποιείται κυρίως ως οργανικός διαλύτης στα χημικά εργαστήρια και είναι επίσης ο δραστικός παράγοντας στην παραγωγή αφαίρεσης βερνικιών νυχιών και λεπτότερων στη βιομηχανία βαφών.
Ακεταλδεΰδη: Η ακετόνη χρησιμοποιείται για την παρασκευή οξικού οξέος, αρωμάτων, βαφών, αρωματικών ουσιών και φαρμάκων.
Χαρακτηριστικά της ακεταλδεΰδης και της ακετόνης
Ταυτοποίηση
Ακετόνη: Η ακετόνη δίνει θετικό αποτέλεσμα για τη δοκιμή ιωδιοφόρμων. Ως εκ τούτου, μπορεί εύκολα να διαφοροποιηθεί από την ακεταλδεΰδη χρησιμοποιώντας τη δοκιμή ιωδιοφόρμων.
Ακεταλδεΰδη: Η ακεταλδεΰδη δίνει ένα ασημί καθρέφτη στο αντιδραστήριο "Tollen" ενώ οι κετόνες δεν δίνουν θετικό αποτέλεσμα για αυτή τη δοκιμή. Επειδή, δεν μπορεί να οξειδωθεί εύκολα. Η δοκιμή χρωμικού οξέος και το αντιδραστήριο Fehling μπορούν επίσης να χρησιμοποιηθούν για την ταυτοποίηση της ακεταλδεΰδης.
Δραστικότητα
Η αντιδραστικότητα των ομάδων καρβονυλίου (αλδεϋδες και κετόνες) οφείλεται κυρίως στην ομάδα καρβονυλίου (C = O).
Ακετόνη: Γενικά, οι αλκυλομάδες είναι ομάδες που δίνουν ηλεκτρόνια. Η ακετόνη έχει δύο μεθυλομάδες και μειώνει την πόλωση της καρβονυλομάδας. Ως εκ τούτου, καθιστά την ένωση λιγότερο αντιδραστική. Δύο μεθυλομάδες συνδεδεμένες και στις δύο πλευρές της ομάδας καρβονυλίου οδηγούν επίσης σε μεγαλύτερη στεατική παρεμπόδιση. Ως εκ τούτου, η ακετόνη είναι λιγότερο δραστική από την ακεταλδεΰδη.
Ακεταλδεϋδη: Αντίθετα, η ακεταλδεΰδη έχει μόνο μία ομάδα μεθυλίου και ένα άτομο υδρογόνου συνδέεται με την ομάδα καρβονυλίου. Καθώς η ομάδα μεθυλίου δωρίζει ηλεκτρόνια, το άτομο υδρογόνου αποσύρει τα ηλεκτρόνια. αυτό κάνει το μόριο περισσότερο πολωμένο, και κάνει το μόριο πιο αντιδραστικό. Σε σύγκριση με την ακετόνη, η ακεταλδεΰδη έχει λιγότερες στεατικές επιδράσεις και άλλα μόρια μπορούν να προσεγγίσουν εύκολα. Λόγω αυτών των λόγων, η ακεταλδεΰδη είναι πιο δραστική από την ακετόνη.




