Διαφορά μεταξύ της οκτάτης και της διουλέτας | Octet vs Duplet
Διαφορά κλειδιού - Οκτίτ εναντίον διπλατίδα
Υπάρχουν χημικά ενεργά και ανενεργά άτομα ή ενώσεις που υπάρχουν στη φύση. Αυτό το χαρακτηριστικό εξαρτάται κυρίως από τον αριθμό των ηλεκτρονίων που υπάρχουν στα εξωτερικά κελύφη των ατόμων. Τα άτομα με μη ολοκληρωμένα κελύφη μπορεί να ενεργοποιηθούν για να ολοκληρώσουν τη διαμόρφωση ηλεκτρονίων τους για να γίνουν σταθερά. Τα άτομα που είναι ανενεργά έχουν πλήρη διαμόρφωση ηλεκτρονίων. Επομένως, αυτά τα άτομα δεν αντιδρούν με κανένα άλλο άτομο εκτός από ειδικές συνθήκες. Τα ευγενή αέρια είναι πάντα αδρανείς στη φύση. Ως εκ τούτου, είναι γνωστά ως αδρανή αέρια. Τα αδρανή αέρια βρίσκονται στην όγδοη στήλη του περιοδικού πίνακα. Άλλα στοιχεία της ίδιας περιόδου (σειράς) τείνουν να αποκτήσουν τη διαμόρφωση ηλεκτρονίων του αδρανούς αερίου στο τέλος αυτής της περιόδου, η οποία είναι η πιο σταθερή μορφή στη φύση. Τα ενεργά άτομα τείνουν να συμπληρώνουν τον αριθμό των ηλεκτρονίων σύμφωνα με τον κανόνα των οκτάδων ή τον κανόνα του στύλου . Η βασική διαφορά μεταξύ οκτάτη και στυπώματος είναι ότι το οκτέτ είναι ένα άτομο ή ένα ιόν που έχει μέγιστο οκτώ ηλεκτρόνια στο εξωτερικό κέλυφος ενώ το στυπτικό είναι ένα άτομο που έχει το μέγιστο των δύο ηλεκτρονίων στο εξωτερικό κέλυφος.
ΠΕΡΙΕΧΟΜΕΝΑ
1. Επισκόπηση και διαφορά κλειδιού
2. Τι είναι το Octet
3. Τι είναι το Duplet
4. Σύγκριση μεταξύ τους - Οκτίτ εναντίον Duplet
5. Περίληψη
Τι είναι το Octet;
Ένα οκτάτο είναι ένα άτομο ή ένα ιόν που έχει οκτώ ηλεκτρόνια στο εξώτατο κέλυφος αυτού του ατόμου. Όλα τα ευγενή αέρια, εκτός από το ήλιο, έχουν οκτώ ηλεκτρόνια και έχουν αδρανή φύση. Η διαμόρφωση ηλεκτρονίων ενός ευγενούς αερίου θα τελειώνει πάντα ως εξής.
Για παράδειγμα, η ηλεκτρονική διαμόρφωση του Neon είναι 1s2 2s 2
2 < 2ρ 6 . Το νέον είναι αδρανές αέριο. Άλλα στοιχεία που έχουν ηλεκτρόνια σε επτά, έξι, κλπ. Στο εξώτατο τροχιακό τείνουν να υπακούν στον κανόνα των οκτάδων, αποκτώντας ηλεκτρόνια από το εξωτερικό. μερικά άλλα στοιχεία που έχουν ένα, δύο, κλπ. τα ηλεκτρόνια τείνουν να χάνουν τα ηλεκτρόνια και να λαμβάνουν τη διαμόρφωση ηλεκτρονίων του πλησιέστερου αδρανούς αερίου. Αλλά άλλα στοιχεία στη μέση του περιοδικού πίνακα θα σχηματίσουν νέους δεσμούς με στοιχεία που έχουν περίσσεια ηλεκτρονίων για να μοιραστούν αυτά τα ηλεκτρόνια και να γίνουν μια οκτάδα.
Το άτομο υδρογόνου και το ήλιο είναι τα μικρότερα στοιχεία στη φύση και έχουν μόνο ένα τροχιά γύρω από τον πυρήνα τους. Αυτό το τροχιά ονομάζεται 1s τροχιά. Αυτό το τροχιακό μπορεί να περιέχει μέχρι δύο ηλεκτρόνια. Το άτομο υδρογόνου έχει ένα ηλεκτρόνιο και το ήλιο έχει δύο ηλεκτρόνια. Ως εκ τούτου, το ήλιο ονομάζεται στύλος.Το ήλιο έχει τον μέγιστο αριθμό ηλεκτρονίων που μπορεί να έχει. επομένως είναι ένα σταθερό στοιχείο στη φύση. Ως εκ τούτου, το Ηελίο είναι επίσης ένα αδρανές αέριο. Αλλά το υδρογόνο έχει μόνο ένα ηλεκτρόνιο και το μόνο τροχιακό που έχει είναι ατελές. Έτσι, το άτομο υδρογόνου από μόνο του είναι πολύ αντιδραστικό και τείνει να σχηματίσει έναν ομοιοπολικό δεσμό με ένα άλλο άτομο υδρογόνου, μοιράζοντας τα μόνα ηλεκτρόνια που έχουν. Στη συνέχεια, αυτά τα άτομα υδρογόνου γίνονται διχαλωτά, καθώς τώρα έχουν δύο ηλεκτρόνια στα εξωτερικά τροχιακά τους. Αλλά το λίθιο μπορεί επίσης να συμπεριφέρεται ως στυπιοθλίπτης αφαιρώντας το ηλεκτρόνιο από το εξωτερικό του τροχιακό. Η διαμόρφωση ηλεκτρονίων του λιθίου είναι 1s
2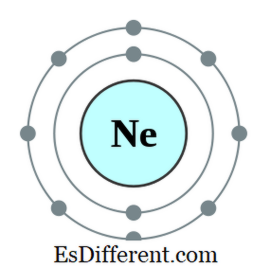
2s
1
. Αφαιρώντας το ηλεκτρόνιο 2s 1 , μπορεί να γίνει στύλος. Σε αυτή την περίπτωση, ο He, H - και ο Li + είναι διπλασιασμοί που μπορούν να υπάρχουν ως σταθερά δευτερεύοντα. Όλα τα duplets έχουν διάρθρωση ηλεκτρονίων που τελειώνει ως εξής. ns 2 Εικόνα 02: Ηλίθιο, ένα στρώμα
Ποια είναι η διαφορά μεταξύ του Octet και του Duplet;
- diff Άρθρο Μέση πριν από τον πίνακα -> Octet vs Duplet

Η οκτάτη έχει οκτώ ηλεκτρόνια στο εξωτερικό κέλυφος.
Το Duplet έχει δύο ηλεκτρόνια στο εξωτερικό κέλυφος.
Κοινή διαμόρφωση ηλεκτρονίων
Η οκτάτη έχει διαμόρφωση ηλεκτρονίων τύπου ns |
|
| 2 | np |
| 6 | |
| . Το Duplet έχει διαμόρφωση τύπου ns 2 στο τέλος. Αριθμός ορχιδέων | Η όχθη μπορεί να έχει τουλάχιστον δύο τροχιακά. Ένα σκίτσο έχει μόνο ένα τροχιακό. Ο τύπος των τροχιακών |
| Μια οκτάδα μπορεί να έχει όλους τους τύπους τροχιακών όπως s, p, d, f, κλπ. | |
| Το Duplet έχει μόνο τροχιακό. | Περίληψη - Octet vs Duplet |
| Όλα τα στοιχεία τείνουν να γίνουν σταθερά. Αλλά με ατελείς ηλεκτρονικές διαμορφώσεις, τα άτομα δεν μπορούν να είναι σταθερά. Έτσι, γίνονται πολύ αντιδραστικές για να γεμίσουν τα κοχύλια με ηλεκτρόνια κερδίζοντας, χάνοντας ή μοιράζοντας ηλεκτρόνια. Τα άτομα ή τα μόρια που υπακούουν στον κανόνα των οκτάδων ή των στύλων είναι σταθερά. Η βασική διαφορά μεταξύ του οκτάτη και του στυπώματος είναι ότι η οκτάδα έχει οκτώ ηλεκτρόνια στο εξώτατο τροχιακό της, ενώ το στυλεό έχει δύο ηλεκτρόνια στο τροχιακό του. | |
| Αναφορές: | 1. Nema, P., 2011. Topperlearning. [Online] Διατίθεται στη διεύθυνση: // www. topperlearning. com / forums / home-work-help-19 / what-is-octet-duplet-valency-και-ιόντα-χημεία-δομή-του-ατόμου-46317 / απάντηση [Accessed 29 05 2017]. |
2. Chang, R., 2010. Χημεία. 10η έκδ. Νέα Υόρκη: McGraw-Hill.
3. Εντός ολίγου., 2015. Φόρτωση βαθμού. [Online] Διατίθεται στη διεύθυνση: // gradestack. COM / NTSE-Complete-Course / Chemical-Bonding / Chemical-Activity-of-An / 19176-3853-37737-study-wtw [Accessed 29 05 2017].
Ευγένεια εικόνας:
1. "Ηλεκτρονικό κέλυφος 002 Helium - χωρίς ετικέτα" Από το Pumbaa (αρχικό έργο του Greg Robson) - Ηλεκτρονικά διαγράμματα κελύφους (αντίστοιχη ετικέτα έκδοση) (CC BY-SA 2. 0 uk) μέσω Commons Wikimedia
2. "Ηλεκτρονικό κέλυφος 010 Neon" Από την Pumbaa (αρχική εργασία του Greg Robson) (CC BY-SA 2. 0 uk) μέσω Wikimedia Commons




