Διαφορά μεταξύ ισοτονικού και υπερτονικού | Isotonic vs Hypertonic
Βασική διαφορά - Ισότονη έναντι Υπερτονική
Είναι σημαντικό να κατανοήσουμε την έννοια της Τονικότητας πριν αναλύσουμε τη διαφορά μεταξύ ισοτονικής και υπερτονικής. Επομένως, ας περιγράψουμε για πρώτη φορά εν συντομία την έννοια της τονικότητας και τη σημασία της. Η τοικότητα είναι η διακύμανση της συγκέντρωσης νερού δύο διαλυμάτων που διαιρούνται με μια ημιδιαπερατή μεμβράνη. Μπορεί επίσης να εξηγηθεί ως η σχετική συγκέντρωση νερού των διαλυμάτων που καθορίζουν την κατεύθυνση και την ποσότητα της διάχυσης του νερού μέχρι να επιτευχθούν ίσες συγκεντρώσεις και στις δύο πλευρές της μεμβράνης. Με τον εντοπισμό της τονικότητας των διαλυμάτων, μπορούμε να προσδιορίσουμε σε ποια κατεύθυνση θα διαχέεται το νερό. Αυτό το φαινόμενο χρησιμοποιείται συνήθως όταν απεικονίζεται η απόκριση των κυττάρων που βυθίζονται σε μια εξωτερική λύση. Υπάρχουν τρεις ταξινομήσεις τονικότητας που μια λύση μπορεί να έχει σε σχέση με άλλη. Είναι υπερτονικοί, υποτονικοί και ισοτονικοί. Η διαφορά κλειδιού μεταξύ ισοτονικού και υπερτονικού είναι ότι το υπερτονικό διάλυμα περιέχει περισσότερο διαλύτη από το διαλυμένο ενώ το η διαλελυμένη ουσία και ο διαλύτης κατανέμονται εξίσου στο ισότονο διάλυμα. Ωστόσο, η απομνημόνευση του ορισμού των υπερτονικών και ισοτονικών λύσεων δεν είναι απαραίτητη αν κατανοήσουμε τη διαφορά μεταξύ ισοτονικών και υπερτονικών λύσεων.
Τι είναι το Hypertonic;
Η Hyper είναι μια άλλη λέξη για παραπάνω ή υπερβολική. Τα υπερτονικά διαλύματα θα έχουν υψηλότερη συγκέντρωση διαλελυμένης ουσίας (γλυκόζη ή άλας) από το κύτταρο. Τα διαλύματα είναι τα στοιχεία που διαλύονται σε ένα διαλύτη, σχηματίζοντας έτσι μια λύση. Σε μια υπερτονική λύση, η συγκέντρωση διαλυμένων ουσιών είναι μεγαλύτερη εκτός του κυττάρου από ότι μέσα σε αυτό. Όταν ένα κύτταρο βυθίζεται σε ένα υπερτονικό διάλυμα, θα υπάρξει μια οσμωτική μετατόπιση και τα μόρια του νερού θα ρέουν έξω από το κύτταρο για να εξισορροπηθεί η συγκέντρωση των διαλελυμένων ουσιών και θα υπάρξει συρρίκνωση στο μέγεθος του κυττάρου.
Τι είναι ισοτονικό;
Το Iso είναι μια άλλη λέξη για την ισότητα και ο τονωτικός είναι για την τονικότητα της λύσης. Οι ισοτονικές λύσεις θα έχουν μια παρόμοια συγκέντρωση διαλυμένης ουσίας από τη λύση που συγκρίνεται με αυτήν. Σε μία ισοτονική λύση, η συγκέντρωση διαλελυμένων ουσιών είναι η ίδια τόσο εντός όσο και εκτός του κυττάρου δημιουργώντας μια ισορροπία στο περιβάλλον της κυτταρικής οργάνωσης. Όταν ένα κύτταρο βυθίζεται σε ισοτονική λύση, δεν θα υπάρξει οσμωτική μετατόπιση και μόρια νερού διαχέονται μέσω της κυτταρικής μεμβράνης και προς τις δύο κατευθύνσεις για να εξισορροπηθεί η συγκέντρωση των διαλελυμένων ουσιών.Αυτή η διαδικασία δεν θα δημιουργήσει οίδημα ή συρρίκνωση του κυττάρου.

Ποια είναι η διαφορά μεταξύ ισοτονικού και υπερτονικού;
Οι διαφορές μεταξύ υπερτονικής και ισοτονικής μπορούν να ταξινομηθούν στις ακόλουθες κατηγορίες.
Ορισμός Ιστονικό και Υπερτονικό
Υπερτονικό: Το "υπερ" είναι γνωστό ως παραπάνω ή υπερβολικό + "τονωτικό" είναι γνωστό ως κάτι κατά μήκος των γραμμών μιας λύσης. Έτσι, η υπερτονική υποδηλώνει αυξημένη τονικότητα του διαλύματος.
Ισότονο: Το "iso" είναι γνωστό ως το ίδιο + "τονωτικό" είναι γνωστό ως κάτι κατά μήκος των γραμμών μιας λύσης. Έτσι, η ισοτονική υποδηλώνει παρόμοια τονικότητα του διαλύματος.
Χαρακτηριστικά Ισοτονική και Υπερτονική
Συγκέντρωση διαλελυμένης ουσίας και διαλύματος
Υπερτονική: Το διάλυμα περιέχει περισσότερο διαλύτη από το διαλυμένο.
Ισότονο: Το διάλυμα και ο διαλύτης στο διάλυμα κατανέμονται με ισότιμο τρόπο.
Παραδείγματα
Υπερτονική: Καθαρισμένο νερό, διότι δεν διαλύεται / διαλυθεί στο καθαρισμένο νερό και η συγκέντρωσή του είναι πολύ χαμηλή σε σύγκριση με το κυτταρικό περιβάλλον.
Ισότονο: Το διάλυμα αλατόνερου είναι ισοτονικό προς το πλάσμα ανθρώπινου αίματος
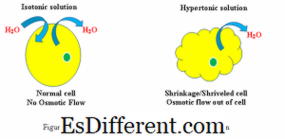
Η απόκριση των κυττάρων σε υπερτονικό και ισοτονικό διάλυμα (βλέπε σχήμα 1)
Υπερτονική: υπερτονικό περιβάλλον, το νερό ρέει διαμέσου της κυτταρικής μεμβράνης εκτός του κυττάρου, προκειμένου να εξισορροπηθεί η συγκέντρωση διαλυμένων ουσιών τόσο στο κύτταρο όσο και στο περιβάλλον γύρω από το κύτταρο. Ως αποτέλεσμα, το κύτταρο θα συρρικνώνεται καθώς το νερό αφήνει το κύτταρο για να μειώσει την υψηλότερη συγκέντρωση διαλελυμένης ουσίας στο εξωτερικό περιβάλλον.
Ισότονο: Όταν ένα κύτταρο βρίσκεται σε ισοτονική λύση, δεν θα δημιουργήσει πρήξιμο ή συρρίκνωση του κυττάρου.
Διαβάθμιση συγκέντρωσης νερού
Υπερτονική: Η συγκέντρωση συγκέντρωσης νερού μπορεί να παρατηρηθεί από το εσωτερικό του κυττάρου στο υπερτονικό διάλυμα
Ισοτονικό: Υπερτονική:
Η βαθμίδα συγκέντρωσης διαλύματος φαίνεται από το υπερτονικό διάλυμα στο εσωτερικό του κελιού
Ισοτονικό: Δεν υπάρχει διαβάθμιση συγκέντρωσης διαλύτη.
Οσμωτική μετατόπιση Υπερτονική:
υπάρχει οσμωτική μετατόπιση.
Ισοτονική: οσμωτική μετατόπιση δεν υπάρχει
Κίνηση νερού Υπερτονική:
Τα μόρια νερού μετακινούνται ή διαχέονται γρήγορα από το εσωτερικό των κυψελών προς τις εξωτερικές κατευθύνσεις του διαλύματος,.
Ισότονα: Τα μόρια του νερού μετακινούνται ή διαχέονται και προς τις δύο κατευθύνσεις και ο ρυθμός διάχυσης του νερού είναι παρόμοιος σε κάθε κατεύθυνση. Έτσι, το κύτταρο είτε θα αποκτήσει είτε θα χάσει νερό.
Αθλητικά ποτά Ισότονα:
Ένα ισοτονικό ποτό περιλαμβάνει παρόμοιες συγκεντρώσεις αλατιού, υδατανθράκων σακχάρου και ηλεκτρολυτών όπως στο ανθρώπινο σώμα. Το ισότονο αθλητικό ποτό προτιμάται συχνά ως διάλυμα στοματικής επανυδάτωσης. Έχει συνήθως 4-8g υδατάνθρακα ανά 100 ml.
Υπερτονικό: Το υπερτονικό ποτό περιλαμβάνει υψηλότερες συγκεντρώσεις αλατιού, υδατανθράκων και ηλεκτρολυτών σακχάρων όπως στο ανθρώπινο σώμα.Συνήθως έχει περίπου 8 g υδατανθράκων ανά 100 ml. Ένα υπερτονικό διάλυμα χρησιμοποιείται επίσης στην οσματοθεραπεία για να διαχειριστεί την εγκεφαλική αιμορραγία. Τα υπερτροφικά αθλητικά ποτά είναι ιδανικά για όσους χρειάζονται πολύ υψηλά επίπεδα ενέργειας.
Συμπερασματικά, υπάρχουν τρεις μορφές λύσεων που βασίζονται στη συγκέντρωση διαλυτής ουσίας και είναι ισοτονικές, υποτονικές και υπερτονικές. Η συγκέντρωση διαλελυμένων ουσιών είναι η ίδια τόσο εντός όσο και εκτός του κυττάρου σε ισοτονικό διάλυμα. Η συγκέντρωση των διαλελυμένων ουσιών είναι μεγαλύτερη μέσα στο κύτταρο από το εξωτερικό περιβάλλον σε ένα υποτονικό διάλυμα ενώ το υπερτονικό διάλυμα είναι εκείνο όπου η συγκέντρωση των διαλυμένων ουσιών είναι μεγαλύτερη έξω από το περιβάλλον από το εσωτερικό των κυττάρων. Αναφορές Mansoor, Μ. Α., Beverly, J., and Sandmann. (2002). Εφαρμοσμένη Φυσική Φαρμακευτική. McGraw-Hill Professional. σελ. 54-57. Voet, D., Judith, G.V. and Charlotte, W.P. (2001). Fundamentals of Biochemistry (Rev. ed.). Νέα Υόρκη: Wiley. Π. 30. Ευχαρίστηση για την εικόνα: "Η οσμωτική πίεση στο διάγραμμα των κυττάρων του αίματος" από το LadyofHats - έκανα τον εαυτό μου με βάση [1], [2], [3] και [4] … (Κοινόχρηστος τομέας) μέσω του Wikimedia Commons




