Διαφορά μεταξύ D στοιχείων στοιχείων και στοιχείων μετάβασης | D Στοιχεία στοιχείου κατά Στοιχεία μετάβασης
στοιχεία είναι αρκετά συγκεχυμένη. Και οι δύο λέξεις χρησιμοποιούνται εναλλακτικά και πολλοί χρησιμοποιούν τη λέξη «στοιχεία μετάβασης» για στοιχεία d-block. Η διαφορά κλειδιού
μεταξύ των στοιχείων D-block και των στοιχείων μετάβασης είναι ότι ενώ όλα τα στοιχεία μετάβασης είναι στοιχεία D-block , . Είναι σαφές ότι τα d-block στοιχεία έχουν d-ηλεκτρόνια στο κέλυφος d-sub. Τα στοιχεία μεταβάσεων είναι τα στοιχεία που σχηματίζουν σταθερά ιόντα που έχουν ελλιπώς γεμάτα d -ορbitals. Για παράδειγμα, ο ψευδάργυρος και το σκάνδιο είναι στοιχεία d-block. αλλά όχι στοιχεία μετάβασης. Ποια είναι τα στοιχεία D-block;
Τα στοιχεία D-block μπορούν να αναγνωριστούν με σαφήνεια χρησιμοποιώντας τη διαμόρφωση ηλεκτρονίων και τη θέση του περιοδικού πίνακα. Το κύριο χαρακτηριστικό του στοιχείου d-block έχει τουλάχιστον ένα ηλεκτρόνιο στο υποκεφάλαιοd- . Το παράξενο πράγμα συμβαίνει όταν η πλήρωση των ηλεκτρονίων σύμφωνα με την αρχή

Aufbau στα στοιχεία d-block είναι, 4s -electrons γεμίζονται πρώτα πριν από 3d -electrons. που σημαίνει ότι τα 3d-elctrons έχουν μεγαλύτερη ενέργεια από τα ηλεκτρόνια των 4s. Αλλά, όταν αφαιρούν τα ηλεκτρόνια για να σχηματίσουν ιόντα, 4s - τα ηλεκτρόδια πρώτα αφαιρούνται από το άτομο.
| Sc | [Ar] 3d | |
| 1 | 4s | 2 Titanium Ti [Αr] 3d |
| 2 | 4s | 2 Βαναδίου V |
| Χρώμιο | Cr | [Ar] 3d 5 4s 1 |
| 2 | Σιδήρου Fe [Ar] 3d 6 | |
| 4s | 2 | 4s 2 Νικέλιο |
| Ni | [Ar] 3d | 8 4s 2 |
| 10 | 4s | 1 Ψευδάργυρος Zn |
| 10 | 4s 2 - 2 | |
| 2s | 2 | 3s 2 Σημείωση: 3p |
| 6 | Τι είναι στοιχεία μετάβασης; | Τα στοιχεία μετάβασης είναι τα στοιχεία που σχηματίζουν σταθερά ιόντα με ατελείωτα γεμάτα d-τροχιακά. Όταν τα ιόντα σχηματίζονται από στοιχεία d-block, καταργούν πρώτα τα s -electrons (n-level) και στη συνέχεια καταργούν τα d |
d επομένως, δεν θεωρούνται στοιχεία μετάβασης.Όλα τα άλλα στοιχεία της d-ομάδας σχηματίζουν σταθερά ιόντα των οποίων έχουν πλήρως γεμισμένα d -λεκτρονικά. Λύσεις μεταβατικών μετάλλων Ποια είναι η διαφορά μεταξύ των Στοιχείων μπλοκ D και στοιχείων μετάβασης; Ορισμός των στοιχείων D-μπλοκ και στοιχεία μετάβασης Στοιχεία D-Block: Τα στοιχεία που έχουν ένα ή περισσότερα d- ηλεκτρονικά στο υποκεφάλαιο
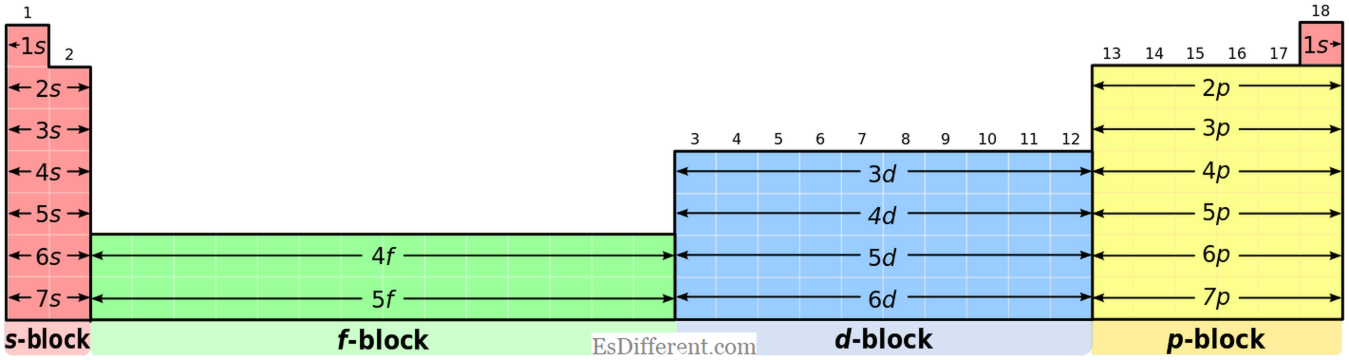
d-
είναι γνωστά ως στοιχεία d-block. Τα περισσότερα στοιχεία d-block είναι μέταλλα. Στοιχεία μετάβασης: Τα στοιχεία που μπορούν να σχηματίσουν σταθερά ιόντα με ελλιπώς γεμάτα d -ορbitals ονομάζονται στοιχεία μετάβασης. Σημείωση: Τα Zn και Sc δεν είναι στοιχεία μετάβασης. Δεν σχηματίζουν μόνο ιόντα Zn 2+ και Sc

3+
, τα οποία δεν περιέχουν μη γεμάτα d-τροχιακά.
Zn
2+ = 1s 2 2s 2 2p
6 3s 2 3p
6
3d 10 Sc 3+ = 1s
2 2s 2 2p 6 3s 2 3p 6 3d 10 Τα ακόλουθα ιόντα περιέχουν μη γεμάτα d-τροχιακά. Ως εκ τούτου, τα στοιχεία αυτά θεωρούνται στοιχεία μετάβασης. Cu 2+
= 1s 2 2s 2 2p 6 3s 2 3p 6 3d 9 Ni 4+
= 1s
2 2s 2 2p 6 3s 2 3ρ 6 3d 6 Mn 2+
3s 2 3ρ 6 3d 5 Fe 2+ 1s 2 2s 2 2ρ 6
3s 2 3p 6 3d 6 Όρια Οξείδωσης: των στοιχείων D-μπλοκ παρουσιάζουν πολλαπλές καταστάσεις οξείδωσης και μερικές από αυτές παρουσιάζουν μία κατάσταση οξειδώσεως. Παράδειγμα: Ο ψευδάργυρος εμφανίζει μόνο κατάσταση οξείδωσης +2 και το Scandium εμφανίζει μόνο +3 κατάσταση οξείδωσης. Άλλα στοιχεία στο d-block δείχνουν πολλαπλές καταστάσεις οξείδωσης. Στοιχεία μετάβασης: Τα στοιχεία μετάβασης εμφανίζουν πολλαπλές καταστάσεις οξείδωσης. Τουλάχιστον μία κατάσταση περιέχει μη συμπληρωμένα d
-ορbitals. Παράδειγμα: Τιτάνιο +2, +4 Βαναδίου +2, +3, +4, +5 Χρώμιο +2, +3, +6 Μαγγάνιο +2, +3, +4, +6, +7 Σιδήρου +2, +3 Κοβάλτιο +2, +3 Νικέλιο +2, +4 Χαλκός +1, +2 : 1. "Περιοδικοί πίνακες πίνακα spdf (32 στήλη)" από τον χρήστη: DePiep [CC BY-SA 3. 0] μέσω Commons 2. "Διαβαθμισμένες μεταβατικές μεταλλικές λύσεις" [Public Domain] μέσω Commons




