Διαφορά μεταξύ 1S και 2s Orbital | 1s vs 2s Orbital
Διαφορά κλειδιού - 1s vs 2s Orbital
Η ατμόσφαιρα είναι η μικρότερη μονάδα της ύλης. Με άλλα λόγια, όλη η ύλη είναι κατασκευασμένη από άτομα. Ένα άτομο αποτελείται από υποατομικά σωματίδια, κυρίως πρωτόνια, ηλεκτρόνια και νετρόνια. Πρωτόνια και ηλεκτρόνια κάνουν τον πυρήνα, ο οποίος βρίσκεται στο κέντρο του ατόμου. Αλλά τα ηλεκτρόνια είναι τοποθετημένα σε τροχιές (ή επίπεδα ενέργειας) που βρίσκονται έξω από τον πυρήνα ενός ατόμου. Είναι επίσης σημαντικό να σημειωθεί ότι τα τροχιακά είναι υποθετικές έννοιες που χρησιμοποιούνται για να εξηγήσουν την πιθανότερη θέση ενός ατόμου. Υπάρχουν διάφοροι τροχιακοί γύρω από τον πυρήνα. Υπάρχουν επίσης υπο-τροχιά όπως s, p, d, f, κλπ. Το υπο-τροχιακό s είναι σφαιρικό σχήμα όταν θεωρείται ως 3D δομή. Το τροχιακό έχει την υψηλότερη πιθανότητα να βρει ένα ηλεκτρόνιο γύρω από τον πυρήνα. Ένα υπο-τροχιακό αριθμημένο και πάλι ως 1s, 2s, 3s, κλπ. Ανάλογα με τα επίπεδα ενέργειας. Η βασική διαφορά μεταξύ των τροχιών 1s και 2s είναι η ενέργεια κάθε τροχιάς. Ο τροχός του 1s έχει χαμηλότερη ενέργεια από την τροχιά του 2s.
ΠΕΡΙΕΧΟΜΕΝΑ
1. Επισκόπηση και διαφορά κλειδιού
2. Τι είναι 1s Orbital
3. Τι είναι το 2s Orbital
4. Σύγκριση μεταξύ τους - 1s vs 2s Orbital
5. Περίληψη
Τι είναι το τροχιακό 1s;
Το orbital του 1s είναι το τροχιακό που βρίσκεται πιο κοντά στον πυρήνα. Έχει τη χαμηλότερη ενέργεια μεταξύ άλλων τροχιακών. Είναι επίσης το μικρότερο σφαιρικό σχήμα. Επομένως, η ακτίνα του τροχιακού είναι μικρή. Μπορεί να υπάρχουν μόνο 2 ηλεκτρόνια στο τροχιακό. Η διαμόρφωση ηλεκτρονίων μπορεί να γραφεί ως 1s 1 , αν υπάρχει μόνο ένα ηλεκτρόνιο στο τροχιακό. Αλλά αν υπάρχει ένα ζεύγος ηλεκτρονίων, μπορεί να γραφτεί ως 1s 2 . Τότε τα δύο ηλεκτρόνια στην τροχιακή κίνηση κινούνται προς τις αντίθετες κατευθύνσεις λόγω της απωλείας που συμβαίνει λόγω των ίδιων ηλεκτρικών φορτίων των δύο ηλεκτρονίων. Όταν υπάρχει ένα μη ζευγαρωμένο ηλεκτρόνιο, ονομάζεται παραμαγνητικό. Αυτό συμβαίνει επειδή μπορεί να προσελκύεται από έναν μαγνήτη. Αλλά αν το τροχιακό είναι γεμάτο και υπάρχει ένα ζεύγος ηλεκτρονίων, τα ηλεκτρόνια δεν μπορούν να έλκονται από έναν μαγνήτη. αυτό είναι γνωστό ως διαμαγνητικό.
Τι είναι το τροχιακό 2s;
Η τροχιά του 2s είναι μεγαλύτερη από 1s τροχιά. Ως εκ τούτου, η ακτίνα της είναι μεγαλύτερη από αυτή της τροχιάς του 1ου. Είναι η επόμενη ντουλάπα τροχιά προς τον πυρήνα μετά από 1s τροχιά. Η ενέργειά του είναι υψηλότερη από την τροχιά του 1ου, αλλά είναι χαμηλότερη από τα άλλα τροχιακά σε ένα άτομο. Η τροχιά του 2s μπορεί επίσης να γεμίσει μόνο με ένα ή δύο ηλεκτρόνια. Αλλά η τροχιά του 2s είναι γεμάτη με ηλεκτρόνια μόνο μετά την ολοκλήρωση της τροχιάς του 1ου.Αυτό ονομάζεται αρχή Aufbau, η οποία υποδεικνύει τη σειρά πλήρωσης ηλεκτρονίων σε υπο-τροχιακά.
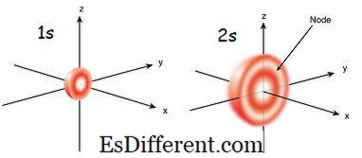
Εικόνα 01: 1s και 2s Τροχιακή
Ποια είναι η διαφορά μεταξύ 1s και 2s Orbital;
- diff Άρθρο Μέση πριν από τον πίνακα ->
1s vs 2s Τροχιακή |
|
| 1s τροχιά είναι η πλησιέστερη τροχιακή στον πυρήνα. | Η τροχιά του 2ου είναι η δεύτερη πλησιέστερη προς τον πυρήνα. |
| Ενεργειακό επίπεδο | |
| Η ενέργεια του τροχιακού 1s είναι υψηλότερη από την τροχιά του 2s. | 2s έχει συγκριτικά χαμηλότερη ενέργεια. |
| Ακτίνα τροχιακού | |
| Η ακτίνα του τροχού του 1s είναι μικρότερη. | Η ακτίνα του τροχού του 2s είναι συγκριτικά μεγάλη. |
| Το μέγεθος του τροχιακού τροχού | |
| 1s έχει το μικρότερο σφαιρικό σχήμα. | Η τροχιά του 2s είναι μεγαλύτερη από την τροχιά του 1ου. |
| Ηλεκτρονική πλήρωση | |
| Τα ηλεκτρόνια πληρώνονται για πρώτη φορά στην τροχιά του 1ου. | Ο τροχός του 2s γεμίζει μόνο μετά την ολοκλήρωση των ηλεκτρονίων στην τροχιά του 1ου. |
Περίληψη - 1s vs 2s Orbital
Ένα άτομο είναι μια δομή 3D που περιέχει έναν πυρήνα στο κέντρο που περιβάλλεται από διαφορετικά διαμορφωμένα τροχιακά διαφορετικών ενεργειακών επιπέδων. Αυτά τα τροχιακά χωρίζονται και πάλι σε υπο-τροχιακά σύμφωνα με μικρές διαφορές ενέργειας. Τα ηλεκτρόνια, τα οποία είναι ένα σημαντικό υποατομικό σωματίδιο ενός ατόμου, βρίσκονται σε αυτά τα επίπεδα ενέργειας. Τα 1s και 2s sub-orbals είναι τα πλησιέστερα στον πυρήνα. Η κύρια διαφορά μεταξύ των τροχιών 1s και 2s είναι η διαφορά του ενεργειακού τους επιπέδου, που είναι, 2s τροχιά είναι ένα επίπεδο ενέργειας υψηλότερο από 1s τροχιά.
Αναφορά:
1. Libretexts. "Ατομικά τροχιακά. "Χημεία LibreTexts. Libretexts, 03 Νοεμβρίου 2015. Web. 26 Μαΐου 2017..
2. Άτομα, ηλεκτρόνια και τροχιακά. Ν. Ρ., n. ρε. Ιστός. 26 Μαΐου 2017..
Ευγένεια εικόνας:
1. "S τροχιακά" (περικοπή) Με το Ίδρυμα CK-12 - Αρχείο: High School Chemistry. pdf, σελίδα 265 (CC BY-SA 3. 0) μέσω Wikimedia Commons


