Διαφορά μεταξύ μερικής πίεσης και πίεσης ατμών
επιστημονικούς όρους σχετικά με την ποσότητα πίεσης που ασκείται από τα συστατικά του συστήματος, αλλά η ταυτότητά τους μπορεί να προκαλέσει σύγχυση σε άλλους. Υπάρχει σαφής διάκριση μεταξύ αυτών των όρων, συμπεριλαμβανομένων των επιπτώσεων και της ταυτότητάς τους. Αυτό το άρθρο θα επεξεργαστεί περισσότερο τις διαφορές μεταξύ αυτών των όρων. Θα περιλαμβάνει επίσης ορισμένα παραδείγματα για την απομυθοποίηση των εφαρμογών αυτών.
Ας ξεκινήσουμε επισημαίνοντας την έννοια της πίεσης προτού μπορέσουμε να βρεθούμε στη διάκριση μεταξύ ατμού και μερικής πίεσης. Η πίεση ορίζεται επιστημονικά ως η δύναμη που εφαρμόζεται ανά μονάδα επιφανείας επί ενός αντικειμένου ή μιας ουσίας. Μπορεί επίσης να οριστεί ως η δύναμη που ασκείται από τα συγκρουόμενα σωματίδια μεταξύ τους και συχνά μετράται χρησιμοποιώντας Pascal. Σε περίπτωση σύγκρουσης σωματιδίων, η εξίσωση αερίων και η κινητική θεωρία των αερίων χρησιμοποιούνται για τον υπολογισμό της πίεσης.
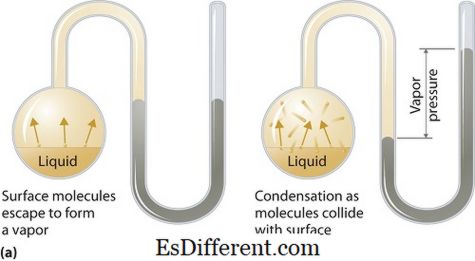
Τι είναι η τάση ατμών;
Η πίεση των ατμών μπορεί να εφαρμοστεί σε υγρές ή στερεές φάσεις. Είναι η πίεση που ασκείται από τον ατμό στη θερμοδυναμική ισορροπία του σε υγρή ή στερεή κατάσταση σε δεδομένη θερμοκρασία σε κλειστό σύστημα όταν βρίσκονται σε επαφή τόσο ο ατμός όσο και το υγρό (στερεό). Αυτή η πίεση προκύπτει ως αποτέλεσμα της εξάτμισης, η οποία επιτυγχάνεται με αυξημένη θερμότητα στο στερεό ή υγρό. Επομένως η θερμοκρασία χρησιμοποιείται ως μέτρο εξατμίσεως και είναι άμεσα ανάλογη προς την τάση ατμών. Αυτό σημαίνει ότι όσο υψηλότερη είναι η θερμοκρασία τόσο υψηλότερη είναι η τάση ατμών.
Κατά την εξάτμιση, τα μόρια του αέρα διαφεύγουν ως αποτέλεσμα της υψηλότερης κινητικής ενέργειας στον αέρα σε ένα κλειστό σύστημα. Στη συνέχεια, όταν βρίσκεται σε ισορροπία, δημιουργείται η τάση ατμών μεταξύ του ατμού και της συμπυκνωμένης μορφής του υγρού (στερεού). Σε λύσεις όπου οι διαμοριακές δυνάμεις είναι ασθενέστερες, η τάση ατμών τείνει να είναι μεγαλύτερη και, αντιστρόφως, σε διαλύματα όπου οι ενδομοριακές δυνάμεις είναι ισχυρότερες, η τάση ατμών είναι μικρότερη.
Η τάση ατμών μπορεί επίσης να συμβεί σε ιδανικά μείγματα όπως εξηγείται από το νόμο του Raoult. Δηλώνει ότι η μερική τάση ατμών ενός συγκεκριμένου συστατικού σε ένα υγρό ή στερεό μείγμα είναι ίση με την τάση ατμών του συστατικού αυτού πολλαπλασιαζόμενη με το γραμμομοριακό του κλάσμα σε αυτό το μείγμα σε δεδομένη θερμοκρασία. Το παρακάτω παράδειγμα θα το καταδείξει.
Παράδειγμα 1.
Λαμβάνοντας υπόψη ένα ιδανικό μίγμα από 0.5 mol. αιθανόλης και 1,5 mol. μεθανόλη με την τάση ατμών 30KPa και 52KPa, αντίστοιχα, προσδιορίζουν τη μερική τάση ατμών για κάθε συστατικό.
Λύση:
Ο συνολικός αριθμός μορίων είναι 1. 5mol + 0. 5mol = 2. 0mol. Σύμφωνα με το νόμο του Raoult, η μερική τάση ατμών είναι ίση με την τάση ατμών πολλαπλασιαζόμενη με το γραμμομοριακό κλάσμα αυτού του συγκεκριμένου συστατικού.Στην περίπτωση αυτή, η Ρ μεθανόλη = 1,5 / 2 * 52 = 39ΚΡα και Ρ αιθανόλη = 0,5/2 * 30 = 7,5KPa.
Όταν έχετε τις μερικές τάσεις ατμών των συστατικών στο μείγμα, μπορείτε να πάρετε τη συνολική πίεση ατμών προσθέτοντάς τα μαζί. Από την άποψη αυτή, τα 7,5 + 39 δίνουν 46,5 kPa συνολική πίεση ατμών του μίγματος αιθανόλης και μεθανόλης.
Παράγοντες που επηρεάζουν την τάση ατμών
Ταυτότητα μορίων
Όπως προαναφέρθηκε, οι τύποι των μοριακών δυνάμεων καθορίζουν την ποσότητα της τάσης ατμών που πρέπει να ασκηθεί. Εάν οι δυνάμεις είναι ισχυρότερες, τότε εμφανίζεται λιγότερη πίεση ατμών, και αν είναι ασθενέστερη, τότε εμφανίζεται μεγαλύτερη πίεση ατμών. Επομένως, η σύνθεση του υγρού ή του στερεού θα επηρεάσει την τάση ατμών.
Θερμοκρασία
Η υψηλότερη θερμοκρασία οδηγεί σε υψηλότερη τάση ατμών, επειδή ενεργοποιεί περισσότερη κινητική ενέργεια για να σπάσει τις μοριακές δυνάμεις, έτσι ώστε τα μόρια να μπορούν να διαφύγουν γρήγορα την υγρή επιφάνεια. Όταν η τάση ατμών (κορεσμένη τάση ατμών) ισούται με την εξωτερική πίεση (ατμοσφαιρική πίεση) το υγρό θα αρχίσει να βράζει. Μια χαμηλότερη θερμοκρασία θα προκύψει με χαμηλή πίεση ατμών και θα χρειαστεί χρόνος για το βρασμό του υγρού.

Νόμος μερικών πιέσεων του Dalton
Τι είναι μερική πίεση;
Η ιδέα της μερικής πίεσης προτάθηκε για πρώτη φορά από τον διάσημο επιστήμονα John Dalton. Γέννησε τον νόμο του για τις μερικές πιέσεις που δηλώνει ότι η συνολική πίεση που ασκείται από ένα ιδανικό μείγμα αερίων είναι ίση με το άθροισμα των μερικών πιέσεων μεμονωμένων αερίων. Πείτε ότι ένα συγκεκριμένο δοχείο είναι γεμάτο με αέρια υδρογόνου, αζώτου και οξυγόνου, η συνολική πίεση, P TOTAL, θα είναι ίση με το άθροισμα οξυγόνου, αζώτου και υδρογόνου. Η μερική πίεση οποιουδήποτε αερίου σε αυτό το μίγμα υπολογίζεται πολλαπλασιάζοντας τη συνολική πίεση με το γραμμομοριακό κλάσμα του μεμονωμένου αερίου.
Με λίγα λόγια, η μερική πίεση είναι η πίεση που ασκείται από ένα συγκεκριμένο αέριο στο μείγμα σαν να δρούσε μόνο του στο σύστημα. Έτσι, αγνοείτε άλλα αέρια όταν καθορίζετε τη μερική πίεση ενός μεμονωμένου αερίου. Αυτή η θεωρία μπορεί να επαληθευθεί με έγχυση, για παράδειγμα, 0,6atm O 2 σε δοχείο 10. 0 L σε 230Κ και στη συνέχεια με ένεση 0,4atm N 2 του ιδίου μεγέθους στην ίδια θερμοκρασία, και στη συνέχεια να συνδυάσουν τελικά τα αέρια για να μετρήσουν τη συνολική πίεση. θα είναι το άθροισμα των δύο αερίων. Αυτό εξηγεί σαφώς τη μερική πίεση ενός μεμονωμένου αερίου σε ένα μίγμα μη δραστικών αερίων.
Υπολογισμός της μερικής πίεσης
Για τον υπολογισμό της μερικής πίεσης είναι απόλυτη αύρα, δεδομένου ότι ο νόμος Dalton [1] προβλέπει διατάξεις γι 'αυτό. Θα εξαρτηθεί από τις τυπικές πληροφορίες που παρέχονται. Εάν, για παράδειγμα, η συνολική πίεση δίνεται για ένα μείγμα αερίου Α και Β καθώς και η πίεση του αερίου Α, η μερική πίεση του Β μπορεί να υπολογιστεί με τη χρήση P TOTAL = P A + P B . Το υπόλοιπο είναι αλγεβρικό χειρισμό. Αλλά σε μια περίπτωση όπου δόθηκε μόνο η συνολική πίεση του μίγματος, μπορείτε να χρησιμοποιήσετε το μοριακό κλάσμα του αερίου Β για να προσδιορίσετε τη μερική πίεση.Το γραμμομοριακό κλάσμα, που δηλώνεται με το Χ, μπορεί να βρεθεί με διαίρεση των γραμμομορίων του αερίου Β από τα συνολικά γραμμομόρια του μείγματος αερίου. Στη συνέχεια, για να βρείτε τη μερική πίεση, θα πολλαπλασιάσετε το μοριακό κλάσμα, Χ, με τη συνολική πίεση. Το παρακάτω παράδειγμα το επεξεργάζεται.
Παράδειγμα 2.
Ενα μείγμα αζώτου και οξυγόνου, με 2.55 moles και 1.85 moles, αντίστοιχα, εγχύεται σε δοχείο 20 λίτρων με συνολική πίεση 4 ατμ. υπολογίστε τη μερική πίεση που ασκείται από το αέριο οξυγόνου.
Λύση:
Ο συνολικός αριθμός των γραμμομορίων στο μείγμα είναι 2. 5 + 1. 85 = 4. 35 moles. Έτσι, το γραμμομοριακό κλάσμα του Οξυγόνου, X o , θα είναι 1. 85 moles / 4. 35 moles = 0,425 moles. Η μερική πίεση του οξυγόνου θα είναι 0. 425 * 4atm = 1. 7atm. Η μερική πίεση του εναπομένοντος αερίου μπορεί να υπολογιστεί ακολουθώντας την ίδια προσέγγιση ή μπορεί να υπολογιστεί με τη χρησιμοποίηση του αερίου οξυγόνου και της συνολικής πίεσης όπως περιγράφεται από τον νόμο των μερικών πιέσεων του Dalton ότι η συνολική πίεση των μη δραστικών αερίων είναι ίση με το άθροισμα τις μερικές πιέσεις.
Διαφορά μεταξύ ατμού και μερικής πίεσης
Από τις παραπάνω εξηγήσεις είναι φανερό ότι η τάση ατμών και η μερική πίεση είναι δύο διαφορετικές πιέσεις. Η τάση ατμών εφαρμόζεται σε υγρές και στερεές φάσεις ενώ η μερική πίεση εφαρμόζεται στην αέρια φάση. Η τάση ατμών ασκείται στη φάση μετάβασης αφού προστεθεί επαρκής θερμότητα στο διάλυμα οδηγώντας έτσι στα μόρια του να διαφύγουν σε ένα κλειστό σύστημα.
Η κύρια διαφορά μεταξύ της μερικής πίεσης και της τάσης ατμών είναι ότι η μερική πίεση είναι η πίεση που ασκείται από ένα μεμονωμένο αέριο σε ένα μείγμα σαν να ήταν μόνο στο σύστημα, ενώ η τάση ατμών αναφέρεται στην πίεση που ασκείται από τον ατμό στην θερμοδυναμική ισορροπία με τη συμπυκνωμένη κατάσταση υγρού ή στερεού. Ο παρακάτω πίνακας δίνει μια συνοπτική σύγκριση αυτών των πιέσεων.
| Πίεση ατμών | Μερική πίεση |
| Εφαρμόζεται από υγρό ή στερεό ατμό στην συμπυκνωμένη φάση σε ισορροπία | Εφαρμόζεται από μεμονωμένα αέρια σε μη αντιδραστικό μείγμα αερίων |
| Καλά εξηγείται από την Raoult's Νόμος | Καλά εξηγείται από το νόμο Dalton |
| Ισχύει σε στερεές και υγρές φάσεις | Ισχύει μόνο σε αέρια φάσεις |
| Ανεξάρτητα από το εμβαδόν ή τον όγκο του συστήματος | όγκος |
| Υπολογίστηκε με τη χρήση του γραμμομοριακού κλάσματος της διαλελυμένης ουσίας | Υπολογίστηκε με τη χρήση του μοριακού κλάσματος του αερίου |
Wrap Up!
Η πίεση των ατμών και η μερική πίεση είναι δύο σημαντικοί επιστημονικοί όροι που χρησιμοποιούνται για τον προσδιορισμό των επιδράσεων των δυνάμεων που ασκούνται από τον ατμό και τα αέρια αντίστοιχα σε δεδομένο κλειστό σύστημα σε συγκεκριμένες θερμοκρασίες. Η κύρια διαφορά τους είναι η περιοχή εφαρμογής με την τάση ατμών που εφαρμόζεται σε υγρές ή στερεές φάσεις, ενώ η μερική πίεση εφαρμόζεται σε ατομικό αέριο σε μίγμα ιδεαίων αερίων σε δεδομένο όγκο.
Η μερική πίεση υπολογίζεται εύκολα ακολουθώντας τον νόμο των μερικών πιέσεων του Dalton, ενώ η πίεση ατμών υπολογίζεται με την εφαρμογή του νόμου του Raoult.Σε κάθε δεδομένο μείγμα, κάθε συστατικό αερίου ασκεί τη δική του πίεση, η οποία ονομάζεται μερική πίεση ανεξάρτητη από άλλα αέρια. Και όταν διπλασιάζετε τα σκουλήκια οποιουδήποτε εξαρτήματος με τη σταθερή θερμοκρασία, θα αυξάνετε τη μερική πίεση. Σύμφωνα με τη σχέση Clausius-Clapeyron [2], η τάση ατμών αυξάνεται όσο αυξάνεται η θερμοκρασία.
Με τις προαναφερθείσες πληροφορίες, πρέπει να μπορείτε να διακρίνετε μεταξύ της πίεσης ατμών και της μερικής πίεσης. Θα πρέπει επίσης να μπορείτε να τα υπολογίσετε χρησιμοποιώντας τα μοριακά κλάσματα και να πολλαπλασιάσετε με τη συνολική πίεση. Σας δώσαμε τυπικά παραδείγματα για να επεξεργαστείτε την εφαρμογή αυτών των πιέσεων.




