Διαφορά μεταξύ μεθάνιο και αιθάνιο | Μεθάνιο Vs Αιθάνιο
vs Ethane
Το μεθάνιο και το αιθάνιο είναι τα μικρότερα μέλη της οικογένειας αλκανίων. Οι μοριακοί τύποι των δύο αυτών οργανικών ενώσεων είναι CH 4 και C 2 H 6 αντίστοιχα. Η διαφορά κλειδιού μεταξύ του μεθτανίου και του αιθανίου είναι η χημική δομή τους . ένα μόριο Αιθάνης μπορεί να θεωρηθεί ως δύο ομάδες μεθυλίου συνδεδεμένες ως διμερές μεθύλ ομάδες. Οι άλλες χημικές και φυσικές διαφορές οφείλονται κυρίως σε αυτή τη διαρθρωτική διαφορά.
Τι είναι το μεθάνιο;
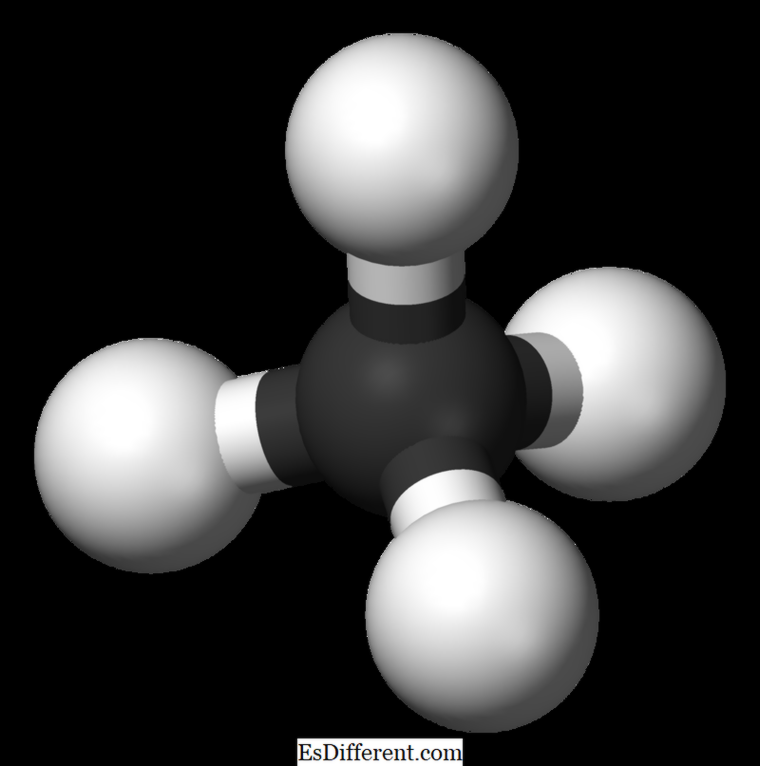
Το μεθάνιο είναι το μικρότερο μέλος της αλκανικής οικογένειας με τον χημικό τύπο CH 4 (τέσσερα άτομα υδρογόνου συνδέονται με ένα άτομο άνθρακα). Θεωρείται ότι αποτελεί το κύριο συστατικό του φυσικού αερίου. Το μεθάνιο είναι ένα άχρωμο, άοσμο και άγευστο αέριο. επίσης γνωστή ως καραντάνιο, αέριο έρπων, φυσικό αέριο, τετραϋδρίδιο του άνθρακα, και υδρογονάνθρακες . Μπορεί εύκολα να αναφλεγεί και ο ατμός του είναι ελαφρύτερος από τον αέρα.
Το μεθάνιο ευρίσκεται φυσικά κάτω από το έδαφος και κάτω από το δάπεδο της θάλασσας. Το ατμοσφαιρικό μεθάνιο θεωρείται ως αέριο θερμοκηπίου. Το μεθάνιο διασπάται σε CH 3 - με νερό στην ατμόσφαιρα.
Τι είναι ο Ethane;
Το αιθάνιο είναι μια άχρωμη, άοσμη αέρια ένωση σε κανονική θερμοκρασία και πίεση. Ο μοριακός του τύπος και το μοριακό βάρος είναι C 2 Η 6 και 30,07 g · mol -1 αντίστοιχα. Απομονώνεται από το φυσικό αέριο, ως υποπροϊόν από τη διαδικασία εξευγενισμού πετρελαίου. Το αιθάνιο είναι πολύ σημαντικό στην παραγωγή αιθυλενίου.

Ποια είναι η διαφορά μεταξύ μεθάνιου και αιθανίου;
Χαρακτηριστικά του μεθανίου και του αιθανίου
Δομή:
Μεθάνιο: Ο μοριακός τύπος του μεθανίου είναι CH 4, ενός τετραεδρικού μορίου με τέσσερις ισοδύναμους δεσμούς CH (δεσμούς σίγμα). Η γωνία δέσμευσης μεταξύ των ατόμων Η-Ο-Η είναι 109. 5 0 και όλοι οι δεσμοί Ο-Η είναι ισοδύναμοι και είναι ίσοι με 108. 70 μ.μ. Ethane:

Ο μοριακός τύπος είναι C 2 H 6, περιέχουν πολλαπλούς δεσμούς. Χημικές ιδιότητες:

Μεθάνιο:
Σταθερότητα:
Το μεθάνιο είναι ένα χημικά πολύ σταθερό μόριο που δεν αντιδρά με KMnO 4 2 O 7 , H 2 SO 4 ή HNO 3 . Καύση: Με την παρουσία περίσσειας αέρα ή οξυγόνου, το μεθάνιο καίγεται με ανοιχτόχρωμη μη φωτεινή φλόγα που παράγει διοξείδιο του άνθρακα και νερό.Είναι μια εξαιρετικά εξωθερμική αντίδραση. Ως εκ τούτου, χρησιμοποιείται ως ένα εξαιρετικό καύσιμο. Σε περίπτωση ανεπαρκούς αέρα ή οξυγόνου, καίγεται εν μέρει σε αέριο μονοξειδίου του άνθρακα (CO). Αντιδράσεις υποκατάστασης: Μεθάνιο εμφανίζει αντιδράσεις υποκατάστασης με αλογόνα. Στις αντιδράσεις αυτές, ένα ή περισσότερα άτομα υδρογόνου αντικαθίστανται από ίσο αριθμό ατόμων αλογόνου και ονομάζεται "αλογόνωση". "Αντιδρά με χλώριο (Cl) και βρώμιο (Br) παρουσία ηλιακού φωτός.
Αντίδραση με ατμό: Όταν ένα μείγμα μεθανίου και ατμού διέρχεται από θερμαινόμενο (1000 K) νικέλιο που στηρίζεται πάνω στην επιφάνεια αλουμίνας, μπορεί να παράγει υδρογόνο.
Πυρόλυση: Όταν θερμαίνεται το μεθάνιο σε περίπου 1300 Κ, αποσυντίθεται σε αιθάλη και υδρογόνο.
Αιθάνιο: Αντιδράσεις:
Το αέριο αιθανίου (CH 3
CH
3 ) αντιδρά με ατμούς βρωμίου παρουσία φωτός για να σχηματίσει βρωμοαιθάνιο > 3 CH 2 Br) και υδροβρώμιο (HBr). Είναι μια αντίδραση υποκατάστασης. ένα άτομο υδρογόνου σε αιθάνιο υποκαθίσταται από άτομο βρωμίου. CH 3 CH 3 + Br
2 CH 3 CH 2 Br + HBr Καύση: Η πλήρης καύση αιθανίου παράγει 1559. 7 kJ / mol (51,9 kJ / g) θερμότητας, διοξειδίου του άνθρακα και νερού. 2 2 Η 6
+ 7 Ο
2 > H 2 O + 3120 kJ Μπορεί επίσης να συμβεί χωρίς περίσσεια οξυγόνου, παράγοντας ένα μίγμα άμορφου άνθρακα και μονοξειδίου του άνθρακα. 2C 2 Η 6 + 3 Ο 2 + ενέργεια
2C
2 Η 6 + 5 2 2 2 O + ενέργεια 2 C < H 2
O + ενέργεια Ορισμοί: Αντιδράσεις αντικατάστασης: Η αντίδραση υποκατάστασης είναι μια χημική αντίδραση που περιλαμβάνει την μετατόπιση μιας λειτουργικής ομάδας σε μια χημική ένωση και την αντικατέστησε με άλλη λειτουργική ομάδα. Χρήσεις: Μεθάνιο: Μεθάνιο χρησιμοποιείται σε πολλές βιομηχανικές χημικές διεργασίες (ως καύσιμο, φυσικό αέριο, υγροποιημένο φυσικό αέριο) και μεταφέρεται ως ψυκτικό υγρό. Αιθάνιο: Το αιθάνιο χρησιμοποιείται ως καύσιμο κινητήρων και ως ψυκτικό μέσο για σύστημα εξαιρετικά χαμηλής θερμοκρασίας. Μεταφέρεται σε χαλύβδινους κυλίνδρους ως υγροποιημένο αέριο υπό την ίδια πίεση ατμών. Αναφορές: "Ethane".
Wikipedia . Ν. Ρ., 2016. Web. 7 Ιουνίου 2016. Khanna, Bhishm. "Ποιες είναι οι χημικές ιδιότητες του μεθανίου; ". Διατηρήστε τα στοιχεία. com . Ν. Ρ., 2016. Web. 7 Ιουνίου 2016. "Μεθάνιο | CH4-Pubchem ". Pubchem. ncbi. nlm. nih. gov . Ν. Ρ., 2016. Web. 7 Ιουνίου 2016. "Μεθάνιο". Wikipedia . Ν. Ρ., 2016. Web. 7 Ιουνίου 2016. Φωτογραφική ευγένεια: "Μικρό μοντέλο μεθανίου" από τον (Δημόσιο Τομέα) μέσω του Wikimedia Commons "Μοντέλο μπλε και μοτίβο μοριακού βάρους αιθανίου" - Ben Mills - Δημόσιος τομέας μέσω Wikimedia Commons "Μεθάνιο" Από Jynto - Η δική του δουλειά, με βάση το φάκελο: Μεθάνιο-CRC-MW-διαστάσεις-2D.png, (Δημόσιος τομέας) μέσω Wikimedia Commons Wikipedia "Ethane" (δημόσιος τομέας) μέσω Wikimedia Commons




