Διαφορά μεταξύ υδροξυλίου και υδροξειδίου | Υδροξύλ εναντίον υδροξειδίου
Διαφορά κλειδιού - Υδροξύλ εναντίον υδροξειδίου
Οι δύο όροι υδροξύλ και υδροξείδιο είναι πολύ παρόμοιοι, διότι και οι δύο έχουν δύο παρόμοια άτομα, οξυγόνο (= 16) και υδρογόνο Η = 1). Το υδροξείδιο είναι ένα αρνητικό ιόν με ένα μόνο φορτίο και το υδροξύλιο δεν βρίσκεται στην ελεύθερη μορφή του, αποτελεί μέρος άλλου μορίου ή ιόντος. Τα ιόντα υδροξειδίου είναι πιο δραστικά από την ομάδα υδροξυλίου σε ένα μόριο. Αυτή είναι η βασική διαφορά μεταξύ υδροξυλίου και υδροξειδίου.
Τι είναι το Hydroxyl;
Το υδροξύλιο είναι μια ουδέτερη ένωση και είναι η αντίστοιχη ηλεκτρικά ουδέτερη ένωση ιόντος υδροξειδίου. Η ελεύθερη μορφή υδροξυλίου (ΗΟ) είναι μια ρίζα και όταν είναι συνδεδεμένη ομοιοπολικά με άλλα μόρια, συμβολίζεται ως ομάδα υδροξυλίου (-ΟΗ). Οι υδροξυλομάδες μπορούν να δράσουν ως πυρηνόφιλα και η ρίζα υδροξυλίου χρησιμοποιείται ως καταλύτης στην οργανική χημεία. Οι ομάδες υδροξυλίου δεν είναι ιδιαίτερα δραστικές όπως τα άλλα πυρηνόφιλα. Εντούτοις, είναι οι διαμεσολαβητές στο σχηματισμό ισχυρών ενδομοριακών δυνάμεων που ονομάζονται «δεσμοί υδρογόνου».

Τι είναι το υδροξείδιο;
Το υδροξείδιο είναι ένα διατομικό ανιόν το οποίο περιέχει ένα άτομο οξυγόνου και ένα άτομο υδρογόνου. Ο δεσμός μεταξύ ατόμου οξυγόνου και υδρογόνου είναι ομοιοπολικός και ο χημικός τύπος του είναι ΟΗ - . Ο αυτο-ιονισμός του νερού παράγει ιόντα υδροξυλίου και επομένως τα ιόντα υδροξυλίου είναι ένα φυσικό μέρος στο νερό. Τα ιόντα υδροξειδίου χρησιμοποιούνται ως βάση, ένας προσδέτης, ένα πυρηνόφιλο και ένας καταλύτης σε χημικές αντιδράσεις. Επιπλέον, ιόντα υδρογόνου παράγουν άλατα με μεταλλικά κατιόντα και τα περισσότερα από αυτά διαχωρίζονται σε υδατικά διαλύματα, απελευθερώνοντας διαλυμένα ιόντα υδροξειδίου. Πολλές ανόργανες χημικές ουσίες περιέχουν στον όρο τους τον όρο "υδροξείδιο", αλλά δεν είναι ιονικές και είναι ομοιοπολικές ενώσεις που περιέχουν ομάδες υδροξυλίου.

Ποια είναι η διαφορά μεταξύ υδροξυλίου και υδροξειδίου;
Δομή:
Υδροξύλιο: Το υδροξύλιο είναι μια ηλεκτρικά ουδέτερη ένωση η οποία μπορεί να βρεθεί με δύο τρόπους, όπως η ριζική και η ομοιοπολικά δεσμευμένη μορφή.

ρίζα υδροξυλίου Όταν είναι ομοιοπολικά συνδεδεμένο με ένα μόριο
Υδροξείδιο: Το υδροξείδιο είναι ένα αρνητικά φορτισμένο ιόν και το αρνητικό φορτίο είναι στο άτομο οξυγόνου.
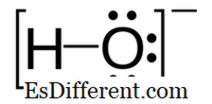
Υδροξύλ: Οι ομάδες υδροξυλίου βρίσκονται σε πολλές οργανικές ενώσεις. αλκοόλες, καρβοξυλικά οξέα και ομάδες υδροξυλίου που περιέχουν ζάχαρη. Ενώσεις που περιέχουν ομάδες υδροξυλίου όπως νερό, αλκοόλες και καρβοξυλικά οξέα μπορούν να αποπρωτονιωθούν εύκολα.Επιπλέον, αυτές οι ομάδες υδροξυλίου εμπλέκονται στο σχηματισμό δεσμών υδρογόνου. Οι δεσμοί υδρογόνου βοηθούν τα μόρια να κολλήσουν μαζί και αυτό οδηγεί στην κατοχή υψηλότερων σημείων βρασμού και τήξης. Γενικά, οι οργανικές ενώσεις είναι ελάχιστα διαλυτές στο νερό. αυτά τα μόρια καθίστανται ελαφρώς υδατοδιαλυτά όταν περιέχουν δύο ή περισσότερες ομάδες υδροξυλίου.
Υδροξείδιο: Οι περισσότερες από τις χημικές ουσίες που περιέχουν υδροξείδιο θεωρούνται πολύ διαβρωτικές και μερικές είναι πολύ επιβλαβείς. Όταν τα χημικά αυτά διαλύονται σε νερό, το ιόν υδροξειδίου δρα ως μια απίστευτα ισχυρή βάση. Δεδομένου ότι το ιόν υδροξειδίου φέρει αρνητικό φορτίο, συχνά συνδέεται με θετικά φορτισμένα ιόντα.
Μερικές ιονικές ενώσεις που περιέχουν υδροξείδια στο μόριο τους διαλύονται πολύ καλά στο νερό. διαβρωτικές βάσεις όπως υδροξείδιο του νατρίου (NaOH) και υδροξείδιο του καλίου (ΚΟΗ) μπορούν να ληφθούν ως παραδείγματα. Ωστόσο, ορισμένες άλλες ιοντικές ενώσεις που περιέχουν υδροξείδιο είναι ελαφρώς αδιάλυτες στο νερό. παραδείγματα είναι το υδροξείδιο του χαλκού (II) [Cu (OH) 2 - φωτεινό μπλε χρώμα] και υδροξείδιο του σιδήρου (II) [Fe (OH) 2 - καφέ].
Δραστικότητα:
Υδροξύλιο : Οι υδροξυλομάδες είναι λιγότερο δραστικές σε σύγκριση με την ομάδα υδροξειδίου. Αλλά, οι ομάδες υδροξυλίου σχηματίζουν εύκολα δεσμούς υδρογόνου και συμβάλλουν στην παραγωγή των μορίων περισσότερο διαλυτών στο νερό.
Ωστόσο, οι ρίζες υδροξυλίου είναι εξαιρετικά δραστικές και πολύ χρήσιμες σε οργανικές χημικές αντιδράσεις.
Υδροξείδιο: Η ομάδα υδροξειδίου (ΟΗ - ) θεωρείται ισχυρό πυρηνόφιλο στην οργανική χημεία.
Αναφορές: Martin. chaplin @ btinternet. com, Μ. C. (n. d.). Ιόντα υδροξειδίου. Ανακτήθηκε στις 28 Δεκεμβρίου 2016, από εδώHydroxide Ion: Ορισμός και τύπος - Video & Lesson Transcript. (ν. δ.). Ανακτήθηκε στις 28 Δεκεμβρίου 2016, από εδώHydroxide. (ν. δ.). Ανακτήθηκε 28 Δεκεμβρίου 2016, από εδώHydroxy ομάδα. (ν. δ.). Ανακτήθηκε στις 28 Δεκεμβρίου 2016, από εδώHydroxyl Group: Ορισμός, δομή & τύπος. (ν. δ.). Ανακτήθηκε στις 28 Δεκεμβρίου 2016, από εδώ H. (2014). Τι είναι μια ομάδα υδροξυλίου; Ανακτήθηκε στις 28 Δεκεμβρίου 2016, από εδώ



