Διαφορά μεταξύ καρβοξυλικού οξέος και εστέρα
είναι οργανικά μόρια με την ομάδα -COO. Ένα άτομο οξυγόνου δεσμεύεται στον άνθρακα με έναν διπλό δεσμό και το άλλο οξυγόνο δεσμεύεται με έναν απλό δεσμό. Δεδομένου ότι μόνο τρία άτομα συνδέονται με το άτομο άνθρακα, έχει τριγωνική επίπεδη γεωμετρία γύρω από αυτό. Περαιτέρω, το άτομο άνθρακα είναι sp
2 υβριδοποιείται. Η ομάδα καρβοξυλίου είναι μια ευρέως εμφανής λειτουργική ομάδα στη χημεία και τη βιοχημεία. Αυτή η ομάδα είναι η μητρική της συγγενικής οικογένειας ενώσεων γνωστών ως ακυλ ενώσεων. Οι ενώσεις ακυλίου είναι επίσης γνωστές ως παράγωγα καρβοξυλικού οξέος. Ο εστέρας είναι ένα παράγωγο καρβοξυλικού οξέος όπως αυτό.
Καρβοξυλικό οξύΤα καρβοξυλικά οξέα είναι οι οργανικές ενώσεις που έχουν τη λειτουργική ομάδα -COOH. Αυτή η ομάδα είναι γνωστή ως καρβοξυλική ομάδα. Το καρβοξυλικό οξύ έχει έναν γενικό τύπο ως εξής.
Στον απλούστερο τύπο του καρβοξυλικού οξέος, η ομάδα R ισούται με το Η. Αυτό το καρβοξυλικό οξύ είναι γνωστό ως μυρμηκικό οξύ. Παρά το μυρμηκικό οξύ, υπάρχουν πολλοί άλλοι τύποι καρβοξυλικών οξέων με διάφορες ομάδες R. Η ομάδα R μπορεί να είναι ευθεία αλυσίδα άνθρακα, διακλαδισμένη αλυσίδα, αρωματική ομάδα, κλπ. Οξικό οξύ, εξανοϊκό οξύ και βενζοϊκό οξύ είναι μερικά από τα παραδείγματα καρβοξυλικών οξέων. Στην ονοματολογία IUPAC, τα καρβοξυλικά οξέα ονομάζονται με την απομάκρυνση του τελικού -
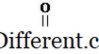
e του ονόματος του αλκανίου που αντιστοιχεί στη μεγαλύτερη αλυσίδα στο οξύ και με την προσθήκη -όικου οξέος. Πάντα, ο καρβοξυλικός άνθρακας έχει τον αριθμό 1. Σύμφωνα με αυτό, το όνομα IUPAC για το οξικό οξύ είναι το αιθανοϊκό οξύ. Εκτός από τα ονόματα IUPAC, πολλά από τα καρβοξυλικά οξέα έχουν κοινά ονόματα.
3 για να σχηματίσουν διαλυτά άλατα νατρίου. Τα καρβοξυλικά οξέα όπως το οξικό οξύ είναι ασθενή οξέα και υπάρχουν σε ισορροπία με τη σύζευγή τους βάση σε υδατικά μέσα. Εντούτοις, εάν τα καρβοξυλικά οξέα έχουν ομάδες λήψης ηλεκτρονίων όπως Cl, F, είναι όξινες από το μη υποκατεστημένο οξύ.
Οι εστέρες έχουν γενικό τύπο RCOOR ». Οι εστέρες παρασκευάζονται με την αντίδραση μεταξύ ενός καρβοξυλικού οξέος και μιας αλκοόλης. Οι εστέρες ονομάζονται καταγράφοντας πρώτα τα ονόματα του μέρους που προέρχεται από αλκοόλη. Στη συνέχεια, το όνομα που προέρχεται από το οξύ μέρος είναι γραμμένο με το τέλος -
ate ή - oate.Για παράδειγμα, ο οξικός αιθυλεστέρας είναι το όνομα του ακόλουθου εστέρα. Οι εστέρες είναι πολικές ενώσεις. Αλλά δεν έχουν την ικανότητα να σχηματίζουν ισχυρούς δεσμούς υδρογόνου μεταξύ τους λόγω της έλλειψης υδρογόνου που περιορίζεται στο οξυγόνο. Ως αποτέλεσμα, οι εστέρες έχουν χαμηλότερα σημεία βρασμού σε σύγκριση με οξέα ή αλκοόλες με παρόμοια μοριακά βάρη. Συχνά οι εστέρες έχουν μια ευχάριστη οσμή, η οποία είναι υπεύθυνη για την παραγωγή των χαρακτηριστικών οσμών φρούτων, λουλουδιών κλπ.

Ποια είναι η διαφορά μεταξύ




