Διαφορά μεταξύ μεταλλικών αλκαλίων και αλκαλικών γαιών | Μέταλλα αλκαλίων έναντι αλκαλικών γαιών Μέταλλα
Δεδομένου ότι τόσο τα αλκαλικά μέταλλα όσο και τα μέταλλα αλκαλικών γαιών είναι οι πρώτες δύο ομάδες του περιοδικού πίνακα, η διαφορά μεταξύ αλκαλικών μετάλλων και αλκαλικών γαιών είναι ένα θέμα ενδιαφέροντος για κάθε φοιτητή χημείας. Τα αλκαλικά μέταλλα και τα μέταλλα των αλκαλικών γαιών ονομάζονται επίσης στοιχεία "S-block" επειδή τα στοιχεία και στις δύο αυτές ομάδες έχουν το εξώτατο τους ηλεκτρόνιο στο s-subshell.
Γενικά, χρησιμοποιήσαμε τη λέξη "μέταλλο" για τα υλικά που παράγουν ηλεκτρική ενέργεια. τόσο αλκαλικά μέταλλα όσο και μέταλλα αλκαλικών γαιών είναι καλοί ηλεκτρικοί και θερμικοί αγωγοί. Τα στοιχεία αυτών των δύο ομάδων είναι τα πλέον δραστικά μέταλλα στον περιοδικό πίνακα. Τα σημεία τήξης τους είναι σχετικά χαμηλά σε σύγκριση με εκείνα άλλων μετάλλων. Τα αλκαλικά μέταλλα και τα μέταλλα αλκαλικών γαιών έχουν πολλές παρόμοιες ιδιότητες, αλλά αυτό το άρθρο ασχολείται κυρίως με τις διαφορές τους.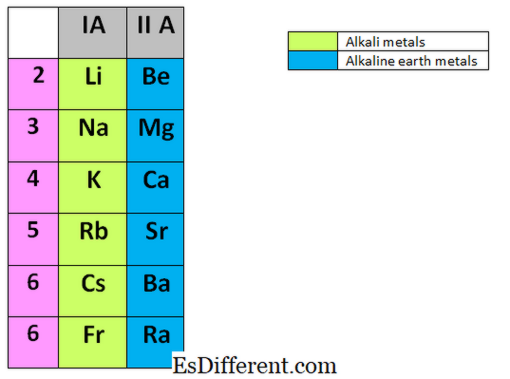
Τα αλκαλικά μέταλλα είναι τα στοιχεία που βρέθηκαν στην πρώτη ομάδα του περιοδικού πίνακα. Πρόκειται για το λίθιο (Li), το νάτριο (Na), το κάλιο (K), το ρουβίδιο (Rb), το καίσιο (Cs) και το Francium (Fr). Είναι όλα μέταλλα και πολύ αντιδραστικά και κανένα από αυτά τα μέταλλα δεν εμφανίζονται ως ελεύθερα μέταλλα στη φύση. Τα μέταλλα αλκαλίων αποθηκεύονται πάντα σε αδρανή υγρά όπως η κηροζίνη, διότι αντιδρούν γρήγορα με τον αέρα, τον υδρατμό και το οξυγόνο στον αέρα. Μερικές φορές αντιδρούν εκρηκτικά με άλλες ουσίες. Μπορούν εύκολα να επιτύχουν την κατάσταση του ευγενούς αερίου, αφαιρώντας το εξώτατο ηλεκτρόνιο στο κέλυφος σθένους.
Οι πυκνότητες του λιθίου και του νατρίου είναι λιγότερες από την πυκνότητα του νερού. Ωστόσο, τα άλλα στοιχεία είναι πυκνότερα από το νερό. Πολλές ενώσεις αλκαλικών μετάλλων (NaCl, KCl, Na 2 CO3, NaOH) είναι εμπορικά πολύ σημαντικές. Τι είναι τα μέταλλα της αλκαλικής γης;
Τα μέταλλα αλκαλικών γαιών βρίσκονται στη δεύτερη ομάδα του περιοδικού πίνακα. Τα στοιχεία της ομάδας ΙΙ περιλαμβάνουν: Βερύλιο (Be), Μαγνήσιο (Mg), Ασβέστιο (Ca), Στρόντιο (Sr), Βάριο (Ba) και Ράδιο (Ra). Παρόμοια με τα αλκαλικά μέταλλα, αυτά τα στοιχεία επίσης δεν εμφανίζονται ελεύθερα στη φύση και είναι επίσης πολύ αντιδραστικά.
Όλα τα στοιχεία αυτής της ομάδας είναι πυκνότερα από το νερό. Τα καθαρά μέταλλα έχουν γκρι ασημί χρώμα, αλλά τείνουν να αποχρωματίζονται γρήγορα όταν εκτίθενται στον αέρα επειδή σχηματίζουν ένα στρώμα οξειδίου στην επιφάνεια. Όπως τα αλκαλικά μέταλλα, αυτά τα μέταλλα είναι επίσης καλοί αγωγοί σε θερμότητα και ηλεκτρισμό.Όλα τα μέταλλα αλκαλικών γαιών είναι εμπορικά πολύτιμα.
Ποια είναι η διαφορά μεταξύ αλκαλικών μετάλλων και αλκαλικών γαιών;
Διαμόρφωση ηλεκτρονίων
- : Τα ηλεκτρονικά μέταλλα έχουν ηλεκτρονική διαμόρφωση [Noble gas] ns 1 και τα μέταλλα αλκαλικών γαιών έχουν ηλεκτρονική διαμόρφωση [Noble gas] ns 2 . Valence
- : Όλα τα μέταλλα αλκαλίων έχουν ένα ηλεκτρόνιο στο εξώτατο κέλυφος τους και όλα τα μέταλλα αλκαλικών γαιών έχουν δύο εξωτερικά ηλεκτρόνια. Για να επιτευχθεί η διαμόρφωση των ευγενών αερίων, τα αλκαλικά μέταλλα πρέπει να χάσουν ένα ηλεκτρόνιο (το σθένος είναι "ένα"), ενώ τα μέταλλα των αλκαλικών γαιών πρέπει να αφαιρέσουν δύο ηλεκτρόνια (το σθένος είναι "δύο"). Δραστικότητα
- : Τα αλκαλικά μέταλλα και τα αλκαλικά μέταλλα είναι πολύ αντιδραστικά. Τα αλκαλικά μέταλλα είναι πιο δραστικά από τα μέταλλα των αλκαλικών γαιών. Ιονικό φορτίο
- : Τα αλκαλικά μέταλλα έχουν +1 ιοντική φόρτιση στις ενώσεις τους και τα μέταλλα των αλκαλικών γαιών έχουν +2 ιονικό φορτίο σε ενώσεις. Σκληρότητα
- : Τα αλκαλικά μέταλλα είναι πολύ μαλακά και μπορούν να κοπούν με αιχμηρό μαχαίρι. Τα γήπεδα αλκαλικών γαιών είναι πιο σκληρά από τα αλκαλικά μέταλλα. Περίληψη:
Μεταλλικά αλκάλια έναντι μέταλλα αλκαλικών γαιών


